题目内容
4.已知A是一种分子量为28的气态烃,现以A为主要原料合成一种具有果香味的物质E,其合成路线如下图所示.
请回答下列问题:
(1)写出A的结构简式CH2=CH2.
(2)B、D分子中的官能团名称分别是羟基、羧基.
(3)物质B可以被直接氧化为D,需要加入的试剂是酸性KMnO4溶液或酸性K2Cr2O7溶液.
(4)写出下列反应的化学方程式:
①CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;反应类型:加成反应.
④CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.反应类型:取代反应或酯化反应.
分析 A 是一种分子量为28的气态烃,也是一种重要的化工原料,A是乙烯,其结构简式为CH2=CH2,乙烯和水发生加成反应生成B,B是乙醇CH3CH2OH,乙醇和氧气反应生成C,C是乙醛CH3CHO,乙醛和氧气反应生成D,D是乙酸 CH3COOH,乙醇和乙酸反应生成E,E是乙酸乙酯CH3COOCH2CH3,根据有机物的结构和性质分析解答
解答 解:A 是一种分子量为28的气态烃,该烃是C2H4,乙烯和水发生加成反应生成B,B是乙醇CH3CH2OH,乙醇和氧气反应生成C,C是乙醛CH3CHO,乙醛和氧气反应生成D,D是乙酸 CH3COOH,乙醇和乙酸反应生成E,E是乙酸乙酯CH3COOCH2CH3,
(1)通过以上分析知,A的结构简式CH2=CH2,
故答案为:CH2=CH2;
(2)B为CH3CH2OH,D为CH3COOH,B、D分子中的官能团名称分别是羟基、羧基,
故答案为:羟基;羧基;
(3)B是乙醇,D是乙酸,乙醇能被酸性高锰酸钾或重铬酸钾氧化生成乙酸,所以需要加入的试剂是酸性高锰酸钾溶液或酸性重铬酸钾溶液,
故答案为:酸性KMnO4溶液或酸性K2Cr2O7溶液;
(4)在催化剂条件下,乙烯和水反应生成乙醇,反应方程式为CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,该反应是加成反应,乙酸和乙醇反应生成乙酸乙酯和水,乙酸中的羟基被-OCH2CH3取代生成乙酸乙酯,所以属于取代反应或置换反应,反应方程式为CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
故答案为:CH2═CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;加成反应;CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;取代反应或酯化反应.
点评 本题考查了有机物的推断,难度不大,明确物质具有的官能团确定其具有的性质,注意官能团的变化,答题时要注意基础知识的灵活运用.

| A. | 物质的量是物质粒子的数量的简称 | |
| B. | 摩尔是用来描述物质所含微粒数目多少的基本物理量 | |
| C. | 我们把含有6.02×1023个粒子的任何粒子的集合体计量为1摩尔 | |
| D. | 1mol H2中含2mol电子 |
| A. | Ca(OH)2?Ca2++2OH- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2CO3?2H++CO32- | D. | Na2SO4═2Na++SO42- |
| A. | 难溶于水 | B. | CH2C12只有一种结构 | ||
| C. | 易燃气体 | D. | 不使高锰酸钾酸性溶液褪色 |
| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 由于乳酸(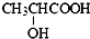 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子 )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体;生产中可利用“手性合成”法主要得到其中一种手性分子 | |
| C. | 许多过渡金属离子对多种配体具有很强的结合力,因而,只有过渡金属才能形成配合物 | |
| D. | 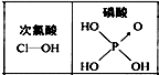 由如图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子 |
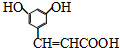
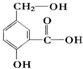 ).则1mol的该有机物跟足量的金属钠反应可以产生1.5molH2,1mol该有机物可以跟1molNaHCO3反应,1mol该有机物可以跟2molNaOH反应.
).则1mol的该有机物跟足量的金属钠反应可以产生1.5molH2,1mol该有机物可以跟1molNaHCO3反应,1mol该有机物可以跟2molNaOH反应.
 .
.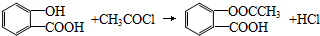 .
. .
.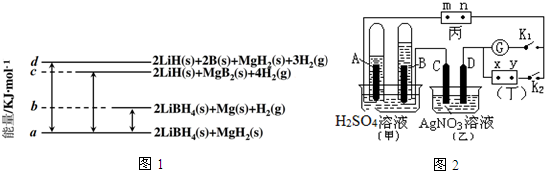
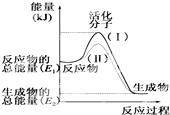 请认真观察如图,然后回答问题:
请认真观察如图,然后回答问题: