题目内容
1.已知还原性CI-<Br-<Fe2+<I-,氧化性CI2>Br2>Fe3+>12,则下列说法正确的是( )| A. | 在含有Br、Fe2+、I-的溶液中欲只氧化I-而不氧化Br、Fe2+,可用FeBr3作试剂 | |
| B. | 向Fel2溶液中通入少量Cl2,反应的离子方程式为:2Fe2++Cl2═2Fe3++2C1- | |
| C. | 向FeBr2溶液中通入足量Cl2,反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4CI- | |
| D. | 向FeCl2溶液中滴加足量碘水,能发生反应:2Fe2++12═2Fe3++2I- |
分析 A、因为还原性Cl-<Br-<Fe2+<I-,只氧化I-而不氧化Br-、Fe2+,所以应加入三价铁离子;
B、因为还原性Cl-<Br-<Fe2+<I-,所以向Fel2溶液中通入少量Cl2,首先氧化碘离子;
C、因为氧化性Cl2>Br2>Fe3+>I2,向FeBr2溶液中通入足量Cl2,完全氧化;
D、因为氧化性Cl2>Br2>Fe3+>I2,所以向FeCl2溶液中滴加足量碘水不反应.
解答 解:A、因为还原性Cl-<Br-<Fe2+<I-,只氧化I-而不氧化Br-、Fe2+,所以应加入三价铁离子,则可用FeBr3作试剂,故A正确;
B、因为还原性Cl-<Br-<Fe2+<I-,所以向Fel2溶液中通入少量Cl2,反应的离子方程式为:2I-+Cl2═I2+2Cl-,故B错误;
C、因为氧化性Cl2>Br2>Fe3+>I2,向FeBr2溶液中通入足量Cl2,反应的离子方程式为:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6CI-,故C错误;
D、因为氧化性Cl2>Br2>Fe3+>I2,所以向FeCl2溶液中滴加足量碘水,不发生反应,故D错误;
故选A.
点评 本题考查了氧化还原反应还原性、氧化性强弱的比较,难度不大,根据“同一化学反应中,氧化剂的还原性大于还原产物的还原性”来分析解答即可.

练习册系列答案
相关题目
11.下列溶液中的氯离子数目与50mL 1mol•L-1的FeCl3溶液中氯离子数目相等( )
| A. | 50 mL 1.5 mol•L-1的FeCl2溶液 | B. | 100 mL 3 mol•L-1的NH4Cl溶液 | ||
| C. | 75 mL 3 mol•L-1的KCl溶液 | D. | 50 mL 2 mol•L-1的CaCl2溶液 |
12.下列物质性质与应用对应关系正确的是( )
| A. | 晶体硅熔点高硬度大,可用于制作半导体材料 | |
| B. | 氢氧化铝胶体具有吸附性,可用于制胃酸中和剂 | |
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| D. | 氧化铁呈红棕色,可用于制作红色涂料 |
16.下列说法中,正确的是( )
| A. | 放热反应不需要加热就可以发生 | |
| B. | 反应条件为加热的反应都是吸热反应 | |
| C. | 化学反应放热还是吸热,取决于反应条件 | |
| D. | 化学反应除了生成新物质外,还伴随着能量的变化 |
6.已知下述三个实验均能发生化学反应.①将铁钉放入硫酸铜溶液中;②向硫酸亚铁溶液中滴入几滴浓硝酸;③将铁钉放入氯化铁溶液中.下列判断正确的是( )
| A. | 实验①和③中的铁钉只作还原剂 | |
| B. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ | |
| C. | 实验②中Fe2+既显氧化性又显还原性 | |
| D. | 实验③中反应的离子方程式为2Fe+Fe3+═3Fe2+ |
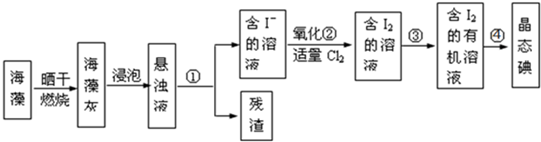
 (1)从含碘的有机溶液中提取碘和回收有机溶剂,需要经过蒸馏,指出下面蒸馏装置图中的错误之处.
(1)从含碘的有机溶液中提取碘和回收有机溶剂,需要经过蒸馏,指出下面蒸馏装置图中的错误之处.