题目内容
12.下列物质性质与应用对应关系正确的是( )| A. | 晶体硅熔点高硬度大,可用于制作半导体材料 | |
| B. | 氢氧化铝胶体具有吸附性,可用于制胃酸中和剂 | |
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| D. | 氧化铁呈红棕色,可用于制作红色涂料 |
分析 A.晶体硅导电性介于导体与半导体之间;
B.氢氧化铝能和酸反应;
C.漂白粉在空气中与水、二氧化碳反应生成不稳定的次氯酸,用于漂白纸张为漂白性;
D.氧化铁是红棕色固体;
解答 解:A.晶体硅用于制作半导体材料与其导电性有关,与其熔点高无关,故A错误;
B.氢氧化铝能和酸反应,可用于制胃酸中和剂,与其吸附性无关,故B错误;
C.漂白粉在空气中与水、二氧化碳反应生成不稳定的次氯酸,用于漂白纸张为漂白性,漂白性与其不稳定性无关,故C错误;
D.氧化铁是红棕色固体,可以作红色涂料,故D正确;
故选:D.
点评 本题主要考查物质的性质、组成以及用途,熟悉物质性质是解题关键,题目难度不大.

练习册系列答案
相关题目
2.下列离子方程式与所述事实相符且正确的是( )
| A. | 向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br-+3Cl2═4Fe3++6Cl-+Br2 | |
| B. | 磁性氧化铁溶于氢碘酸:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| C. | 放置在空气中的淀粉碘化钾溶液一段时间后溶液呈蓝色:4H++4I-+O2═2I2+2H2O | |
| D. | 向硝酸铵溶液中滴加NaOH溶液:NH4++OH-═NH3↑+H2O |
7.在一定温度下,可逆反应X(g)+3Y(g)?2Z(g)达到平衡的标志是( )
| A. | 单位时间内生成amolX,同时生成3amolY | |
| B. | X、Y、Z的分子数之比为1:3:2 | |
| C. | Z的生成速率与Z的分解速率相等 | |
| D. | 单位时间生成3amolY,同时生成3amolZ |
17.在下述条件下,一定能大量共存的离子组是( )
| A. | 透明的水溶液中:K+、Mg2+、SO42-、MnO4- | |
| B. | 含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ | |
| C. | 在pH=7的溶液中:Na+、Fe3+、SO42-、Br- | |
| D. | 强碱性溶液中:ClO-、S2-、HSO3-、Na+ |
4.下列示意图与对应的反应情况正确的是( )
| A. |  含0.01 mol NaOH和0.01 mol Ba(OH)2的混合溶液中缓慢通入CO2 | |
| B. |  KHCO3溶液中逐滴加入Ba(OH)2溶液 | |
| C. | 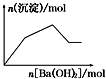 KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 | |
| D. | 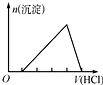 向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸 |
1.已知还原性CI-<Br-<Fe2+<I-,氧化性CI2>Br2>Fe3+>12,则下列说法正确的是( )
| A. | 在含有Br、Fe2+、I-的溶液中欲只氧化I-而不氧化Br、Fe2+,可用FeBr3作试剂 | |
| B. | 向Fel2溶液中通入少量Cl2,反应的离子方程式为:2Fe2++Cl2═2Fe3++2C1- | |
| C. | 向FeBr2溶液中通入足量Cl2,反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4CI- | |
| D. | 向FeCl2溶液中滴加足量碘水,能发生反应:2Fe2++12═2Fe3++2I- |
2.物质不需要通过化学变化就能体现的性质是( )
| A. | 可燃性 | B. | 不稳定性 | C. | 挥发性 | D. | 还原性 |