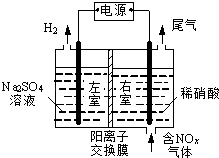
题目内容
【题目】织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.25℃时,各组分含量随pH变化情况如图所示(Cl﹣没有画出),下列说法错误的是 ( )( ) 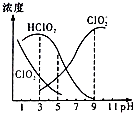
A.25℃时,HClO2的电离平衡常数的数值Ka=10﹣6
B.使用该漂白剂的最佳pH为3.0
C.25℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合后,混合溶液中:c(HClO2)+2c(H+)=c(ClO2﹣)+2c(OH﹣)
D.该温度下NaClO2溶液中:c(Na+)>c(ClO2﹣)>c(OH﹣)>c(H+)
【答案】B
【解析】解:A.由图可知,亚氯酸与亚氯酸根离子浓度相等时,溶液的pH=6,结合图示数据可知,溶液中c(ClO2﹣)=c(HClO2),HClO2的电离平衡常数K= ![]() =10﹣6 , 故A正确;B.HClO2是漂白织物的有效成分,ClO2是有毒气体,要使漂白剂的漂白性强,即HClO2的含量高,又要使ClO2浓度较小,根据图像知,pH过小,ClO2含量较大,pH过大,HClO2的含量较低,当溶液的pH为4.0~5时二者兼顾,即为使用该漂白剂的最佳pH,应该是4﹣5,故B错误;
=10﹣6 , 故A正确;B.HClO2是漂白织物的有效成分,ClO2是有毒气体,要使漂白剂的漂白性强,即HClO2的含量高,又要使ClO2浓度较小,根据图像知,pH过小,ClO2含量较大,pH过大,HClO2的含量较低,当溶液的pH为4.0~5时二者兼顾,即为使用该漂白剂的最佳pH,应该是4﹣5,故B错误;
C.依据电中性原则得出:c(H+)+c(Na+)=c(ClO2﹣)+c(OH﹣) ①,依据物料守恒得出:2c(Na+)=c(ClO2﹣)+c(HClO2) ②,联立①②消去钠离子:c(HClO2)+2c(H+)=c(ClO2﹣)+2c(OH﹣),故C正确;
D.NaClO2溶液中ClO2﹣水解显碱性,则c(OH﹣)>c(H+),由于水解程度较小,所以溶液中离子浓度大小关系为:c(Na+)>c(ClO2﹣)>c(OH﹣)>c(H+),故D正确.
故选B.
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.

【题目】以苯甲醛为原料制取苯甲醇和苯甲酸的合成反应如下: 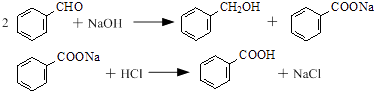
相关物质的部分物理性质见下表:
名称 | 相对密度 | 熔点(℃) | 沸点(℃) | 溶解度 | |
水 | 乙醚 | ||||
苯甲醛 | 1.04 | ﹣26 | 179.6 | 微溶 | 易溶 |
苯甲酸 | 1.27 | 122.1 | 249 | 25℃微溶,95℃可溶 | 易溶 |
苯甲醇 | 1.04 | ﹣15.3 | 205.7 | 微溶 | 易溶 |
乙醚 | 0.71 | ﹣116.3 | 34.6 | 不溶 | ﹣﹣ |
实验流程如下:
(1)萃取时苯甲醇在分液漏斗的(填“上”或“下”)层,分液漏斗振摇过程中需慢慢开启旋塞几次,其原因是 .
(2)用NaHSO3溶液、10%Na2CO3溶液、H2O洗涤乙醚层. ①用10%Na2CO3溶液洗涤目的是 .
②操作Ⅰ名称是 .
(3)抽滤操作结束时先后进行的操作是 .
(4)提纯粗产品乙的实验方法为 .
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: ①配制混酸:组装如图反应装置.取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中.把18 mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50﹣60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.已知
(i) ![]() +HNO3(浓)
+HNO3(浓) ![]()
![]() +H2O
+H2O 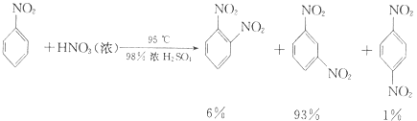
(ii)可能用到的有关数据列表如下
物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/gcm﹣3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
1,3﹣二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
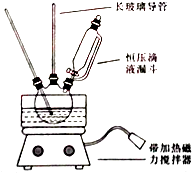
请回答下列问题:
(1)配置混酸应先在烧杯中先加入 .
(2)恒压滴液漏斗的优点是 .
(3)实验装置中长玻璃管可用代替(填仪器名称).
(4)反应结束后产品在液体的层(填“上”或者“下”),分离混酸和产品的操作方法为
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? .
(6)为了得到更纯净的硝基苯,还须先向液体中加入除去水,然后蒸馏,最终得到17.5g硝基苯,则硝基苯的产率为(保留两位有效数字).若加热后,发现未加沸石,应采取的操作是 .