题目内容
【题目】为了将混有Na2SO4、NaHCO3的NaCl固体提纯,制得纯净的氯化钠溶液,某学习小组设计了如下图所示的实验方案:
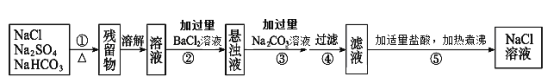
回答下列问题:
(1)操作①加热过程中,发生反应的化学方程式是_______。
(2)操作②不用Ba(NO3)2溶液的理由是:__________。
(3)进行操作②中,判断“BaCl2溶液是否过量”的方法是:_________。
(4)操作③“加入过量Na2CO3溶液”的目的是:________。
(5)操作⑤中“加适量盐酸”的主要目的是__________。
【答案】2NaHCO3![]() Na2CO3 + CO2↑ + H2O 使用Ba(NO3)2溶液,会引入难于除去的NO3-杂质离子 在滴加BaCl2溶液的过程中,静置,取上层清液放入试管中,再加入几滴BaCl2,若无沉淀生成,则证明BaCl2足量 除去过量的Ba2+ 除去过量的CO32—
Na2CO3 + CO2↑ + H2O 使用Ba(NO3)2溶液,会引入难于除去的NO3-杂质离子 在滴加BaCl2溶液的过程中,静置,取上层清液放入试管中,再加入几滴BaCl2,若无沉淀生成,则证明BaCl2足量 除去过量的Ba2+ 除去过量的CO32—
【解析】
(1)操作①加热过程中NaHCO3受热分解;
(2)操作②加BaCl2目的是为了除去CO32-和SO42-,Ba(NO3)2会引入新的离子NO3-;
(3)判断“BaCl2溶液是否过量”的方法是:在滴加BaCl2溶液的过程中,静置,取上层清液放入试管中,再加入几滴BaCl2,若无沉淀生成,则证明BaCl2足量;
(4)操作③“加入过量Na2CO3溶液”的目的是除去过量的Ba2+;
(5)操作⑤中“加适量盐酸”的主要目的是除去过量的CO32-。
(1)操作①加热过程中NaHCO3受热分解:![]() ,故答案为:
,故答案为:![]() ;
;
(2)操作②加BaCl2目的是为了除去CO32-和SO42-,Ba(NO3)2会引入新的杂质离子NO3-,故答案为:使用Ba(NO3)2溶液,会引入难于除去的NO3-杂质离子;
(3)判断“BaCl2溶液是否过量”的方法是:在滴加BaCl2溶液的过程中,静置,取上层清液放入试管中,再加入几滴BaCl2,若无沉淀生成,则证明BaCl2足量,故答案为:在滴加BaCl2溶液的过程中,静置,取上层清液放入试管中,再加入几滴BaCl2,若无沉淀生成,则证明BaCl2足量;
(4)由于悬浊液中含有过量的Ba2+,加入过量Na2CO3溶液的目的是除去过量的Ba2+,故答案为:除去过量的Ba2+;
(5)滤液中含有过量的Na2CO3溶液加适量盐酸的主要目的是除去过量的CO32-,故答案为:除去过量的CO32-。

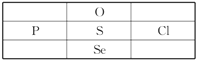
【题目】下表为元素周期表的一部分,表中列出11种元素在周期表中的位置,按要求回答下列各题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑧ | ||||||
3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
4 | ② | ④ | ⑩ |
(1)这11种元素中,化学性质最不活泼的元素是______(填元素符号,下同),失电子能力最强的原子是______,得电子能力最强的单质与水反应的化学方程式是______________,常温下单质为液态的非金属单质是____________;
(2)⑦⑧⑨气氢化物的稳定性:________>________>________
(3)写出③的单质置换出⑥的单质的化学方程式:__________________;
①和⑤两种元素最高价氧化物对应的水化物相互反应的化学方程式为_____________;
⑨的最高价氧化物对应水化物的水溶液与⑤的最高价氧化物反应的离子方程式为________。