题目内容
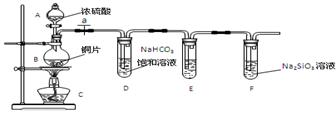
某校化学小组为探究铁与浓硫酸反应是否生成SO2,设计了以下装置进行实验。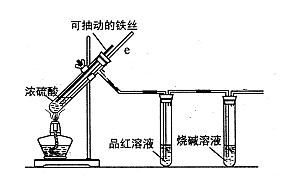
(1)写出铁与浓硫酸反应的化学方程式 ;
若在取用浓硫酸的过程中,不慎在皮肤上沾少量浓硫酸,处理的方法是 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是 。
(3)品红溶液的作用是 。
(4)小组讨论后认为:由于常用的铁丝是铁碳合金,生成的气体中还可能含有CO2。写出生成CO2的化学方程式 。
(1)2Fe + 6H2SO4(浓) 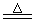 Fe2(SO4)3 + 3SO2↑ + 6H2O (2分)
Fe2(SO4)3 + 3SO2↑ + 6H2O (2分)
立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液 (2分)
(2)停止加热时,防止倒吸或平衡压强 (1分)
(3)检验是否生成SO2(1分)
(4)C + 2H2SO4 CO2↑+2SO2↑+2H2O(2分)
CO2↑+2SO2↑+2H2O(2分)
解析试题分析: 铁与浓硫酸在加热的条件下可反应生成硫酸铁、二氧化硫和水,浓硫酸具有强氧化性和腐蚀性,故少量的浓硫酸不慎滴在皮肤上应立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液,若是大量的浓硫酸,应先用干布拭擦,再用大量水冲洗,再涂上3%~5%的NaHCO3溶液。导气管e作用:导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境,停止加热时,防止倒吸或平衡压强。二氧化硫可以使品红溶液褪色,故二氧化硫可以用品红溶液来检查产物是否生成二氧化硫。铁丝是铁碳合金,含有碳,而浓硫酸具有强氧化性,可以与碳反应生成二氧化碳,二氧化硫和水。
考点:考查浓硫酸与铁反应的相关知识点。

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案在一只试管中装入NO2和NO混合气体a升(常温常压,下同。不考虑NO2转化为N2O4。),倒扣在水槽中,与水充分反应后剩余气体b升(不含水蒸气),再通入c 升O2,试管内刚好无气体剩余。
(1)b的值为 (用只含c的代数式表示)。
(2)填表。
| 表达要求 | 只含b的代数式 | 只含c的代数式 |
| a的取值范围 | | |
(3)写出只含c的代数式的推导过程。
在500mL 0.2 mol·L-1的稀硝酸中加入1.92g铜片,让其充分反应。试求:
(1)产生的气体在标准状况下所占的体积为多少?
(2)反应后溶液中H+的物质的量浓度是多少?(溶液体积变化忽略不计)
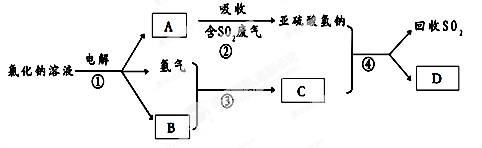
(22分)黄铁矿(FeS2)燃烧产生的SO2通过下列工艺过程既能制得H2SO4,又能制得H2。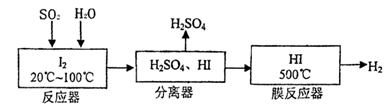
(1)该过程中能循环利用的物质为 。
(2)写出反应器中发生反应的离子方程式 。
(3)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀,进行如下实验。
已知浓硫酸的沸点为338oC,加热时酒精灯火焰的温度为400oC~500oC。
①甲同学用装置I(如下图)进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸,该实验结论不能说明SO2能与BaCl2溶液发生反应,请解释生成该白色沉淀的两种可能原因(用文字和离子方程式表示):
,
;
②乙同学设计了装置Ⅱ(夹持装置和A的加热装置略去)进行实验,发现C中没有出现白色沉淀。
装置Ⅱ改进了装置I的四处不足,请填表说明另外的三处。
| 改进的操作或装置(注明必要的试剂) | 改进的作用 |
| 使用分液漏斗滴加浓硫酸 | 控制反应速率 |
| | |
| | |
| | |
a.NaOH溶液 b.H2O2溶液 C.新制氯水 d.酸性KMnO4溶液