题目内容
在500mL 0.2 mol·L-1的稀硝酸中加入1.92g铜片,让其充分反应。试求:
(1)产生的气体在标准状况下所占的体积为多少?
(2)反应后溶液中H+的物质的量浓度是多少?(溶液体积变化忽略不计)
(1)NO在标准状况下的体积是0.448L;(2)反应后溶液中H+的物质的量浓度是0.04mol/L。
解析试题分析:(1)(5分) n(HNO3)= V·c =(500mL÷1000mL/L)×0.2 mol·L-1=0.1 mol
n(Cu)=" m/M" =" 1.92g" ÷64 g.mol-1 = 0.03mol 可知,稀硝酸过量。
设生成的一氧化氮物质的量为x ,消耗HNO3的物质的量为y,
则3 Cu + 8 HNO3 =" 3" Cu(NO3)2 + 2 NO ↑+ 4 H2O
3 8 2
0.03mol y x
得:2 : x ="3:" 0.03mol 解得:x =" 0.02" mol y =" 0.08" mol.
一氧化氮在标准状况下的体积:V = n·Vm =" 0.02" mol × 22.4L/mol = 0.448L
(2)(2分)反应后溶液中剩余的稀硝酸物质的量:
n(HNO3剩)=" 0.1" mol-0.08 mol ="0.02" mol
反应后溶液中H+的物质的量浓度:
c =" n/V" =" (" 0.02 mol / 500mL) ×1000mL/L = 0.04mol/L.
考点:考查物质的量在化学反应中的应用的相关知识点。

 名师金手指领衔课时系列答案
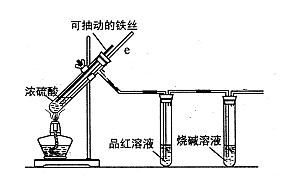
名师金手指领衔课时系列答案某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。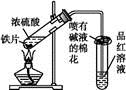
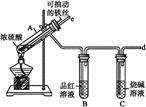
图1 图2
(1)比较两实验装置,图2装置的优点是:
①能更好地吸收有毒气体SO2,防止其污染环境;
② 。(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而污染环境;二是 。(3)能说明有SO2气体产生的实验现象是 。(4)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
| A.稀HCl溶液 | B.稀H2SO4溶液 |
| C.KSCN溶液 | D.KMnO4溶液 |
G.H2O2溶液

 Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为 。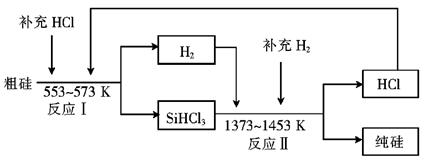
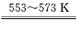 SiHCl3+H2,
SiHCl3+H2,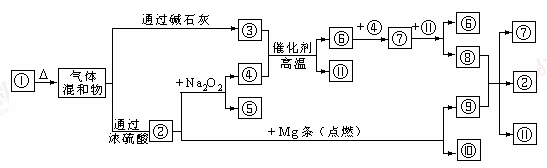
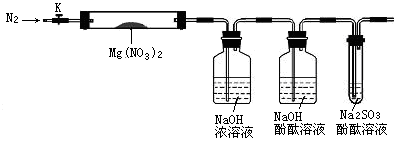
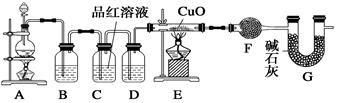
 ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。
ZnSO4+SO2↑+2H2O制取22.4 L(标准状况)SO2气体。取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解。对于制得的气体,有同学认为可能混有氢气。为此,化学小组的同学设计了如下实验装置,对所制取的气体进行探究。