题目内容
【题目】亚硝酸钠是一种重要的化工原料,请回答下列问题:
I.高铁酸钾(K2FeO4)溶液呈紫红色,向其中加入过量亚硝酸钠后,溶液紫红色逐渐褪去,并出现红褐色沉淀,请写出该反应的离子方程式__________。
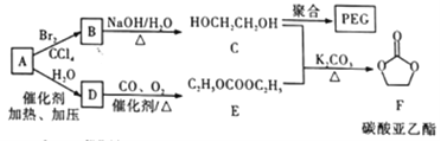
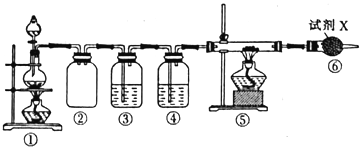
II.实验室模拟下图所示流程制备亚硝酸钠:

已知:①氧化过程中,控制反应温度在35~60℃条件下主要发生反应:
C6H12O6+12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O
②氢氧化钠溶液吸收NO和NO2发生反应:
NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O

(1)木屑的主要成分是纤维素,结合已知信息①,你认为向木屑中加稀硫酸的作用是______,氧化过程中反应温度不宜高于60℃,原因是______________。
(2)不做任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除了OH-外还有两种阴离子,其中一种是NO2-,NO2-与另一种阴离子的物质的量之比为________。
(3)装置B用于制备NaNO2,盛装的试剂除NaOH(aq)外,还可以是______(填字母)。
a.NaCl(aq) b.Na2CO3(aq) c.NaNO3(aq)
III.测定产品纯度:
【实验步骤】①准确称量ag产品配成200mL溶液;②从步骤①配制的溶液中移取20.00mL加入锥形瓶中;③用cmol/L酸性KMnO4溶液滴定至终点;④重复以上操作3次,消耗酸性KMnO4溶液的平均体积为VmL
(1)锥形瓶中发生反应的离子方程式为_____________。达到滴定终点的现象是_________。
(2)产品中NaNO2的纯度为__________。
【答案】 2FeO42-+3NO2-+5H2O=2Fe(OH)3↓+3NO3-+4OH- 催化纤维素水解 硝酸受热易分解 3:1 b 5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O 当滴入最后一滴酸性KMnO4溶液,溶液由无色变为浅红色,且半分钟不褪色 ![]()
【解析】I.高铁酸钾(K2FeO4)与亚硝酸钠反应生成氢氧化铁沉淀同时亚硝酸根离子被氧化为硝酸根离子,反应的离子方程式为:2FeO42-+3NO2-+5H2O=2Fe(OH)3↓+3NO3-+4OH- ;II. (1)木屑的主要成分是纤维素,结合已知信息①氧化过程中,控制反应温度在35~60℃条件下主要发生反应:
C6H12O6+12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O,则向木屑中加稀硫酸的作用是催化纤维素水解,氧化过程中反应温度不宜高于60℃,原因是硝酸受热易分解;(2)不做任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除了OH-外还有两种阴离子,其中一种是NO2-,另一种为NO3-,根据反应C6H12O6+12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O可知,得到的NO和NO2的体积比为1:3,根据反应NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O可得反应NO+3NO2+4NaOH=3NaNO2 +NaNO3+2H2O,所以溶液中NO2-与NO3-的物质的量之比为3:1;(3)装置B用于制备NaNO2,盛装的试剂为NaOH溶液呈碱性,可以用碳酸钠溶液代替,答案选b;III. (1)锥形瓶中发生反应为高锰酸钾氧化亚硝酸钠,反应的离子方程式为5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;达到滴定终点的现象是当滴入最后一滴酸性KMnO4溶液,溶液由无色变为浅红色,且半分钟不褪色;(2)高锰酸钾的物质的量为cV ![]() ,根据反应5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O可知,亚硝酸钠的物质的量为2.5cV
,根据反应5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O可知,亚硝酸钠的物质的量为2.5cV ![]() ,所以产品中NaNO2的纯度为
,所以产品中NaNO2的纯度为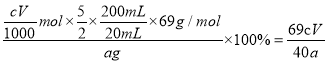 。
。

【题目】某学习小组研究溶液中Fe2+的稳定性,进行如下实验,记录结果。
【实验Ⅰ】
物质 | 0 min | 1min | 1h | 5h |
FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
((NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
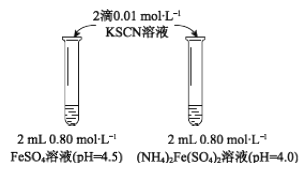
(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是_____________(用离子方程式表示)。溶液的稳定性:FeSO4_______(NH4)2Fe(SO4)2(填“>”或“<”)。
(2)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性。进行【实验Ⅱ】,否定了该观点,请补全该实验。
操作 | 现象 |
取__________,滴加_______,观察。 | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同。 |
(3)乙同学提出【实验Ⅰ】中两溶液的稳定性差异是溶液酸性不同导致,进行【实验III】,分别配制0.8 mol![]() L—pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
L—pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。
资料显示:亚铁盐溶液中存在反应4Fe2++O2+10H2O ![]() 4Fe(OH)3+8H+
4Fe(OH)3+8H+
由【实验III】,乙同学可得出实验的结论是___________________________,原因是___________________________________________________________。
(4)进一步研究在水溶液中
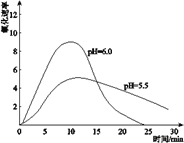
(5)综合以上实验,增强Fe2+稳定性的措施有__________________________。
(6)向溶液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、用蒸馏水洗涤和_____________________,应选用___________式滴定管。
②若滴定xmL滤液中的Fe2+,消耗amol·L—1K2Cr2O7标准溶液bmL,则滤液中c(Fe2+)=______mol·L-1。