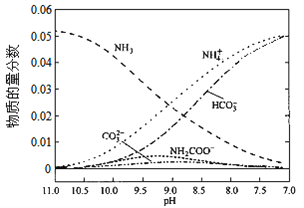
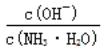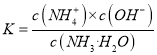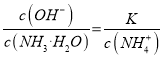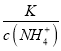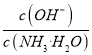题目内容
【题目】(1)按如图所示操作,充分反应后:

①Ⅰ中发生反应的离子方程式为_____________________________________________;
②Ⅱ中铜丝上观察到的现象是________________________________________________;
③结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为______________________。
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应物中还原产物是____________;若反应方程式中转移了0.3 mol电子,则氧化产物的质量是________g。
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2===2Fe3++2Cl-,这个事实说明具有还原性的粒子还原性强弱为_________________________________________。
【答案】Fe+Cu2+===Fe2++Cu 红色铜丝上有银白色金属附着 Ag+>Cu2+>Fe2+ NO 4.8 Fe2+>Br->Cl-
【解析】
(1)铁与CuSO4溶液发生反应:Fe+Cu2+===Fe2++Cu,氧化性Cu2+>Fe2+,Cu与AgNO3溶液发生反应Cu+2Ag+===Cu2++2Ag,Ag附着在Cu的表面,氧化性Cu2+<Ag+,故氧化性Ag+>Cu2+>Fe2+。
(2)由于HNO3中的N为+5价,为氮元素的最高化合价,只具有氧化性,H2S中的S为-2价,只具有还原性,故此反应为HNO3+H2S→S↓+NO+H2O,还原产物为NO,氧化产物为S,由硫元素的化合价变化可知,当转移2 mol e-时生成32 g S,故转移0.3 mol e-时,得到S的质量为4.8 g。
(3)Fe2+、Br-均具有还原性,当通入少量Cl2时,只有Fe2+被氧化,说明还原性Fe2+>Br->Cl-。
(1)①Ⅰ中发生Fe与硫酸铜的置换反应生成Cu和硫酸亚铁,离子反应为Fe+Cu2+===Fe2++Cu,
故答案为:Fe+Cu2+===Fe2++Cu;
②Ⅱ中发生Cu与硝酸银的置换反应,该反应为Cu+2AgNO3=Cu(NO3)2+2Ag,观察到红色铜丝上有白色金属Ag附着,
故答案为:红色铜丝上有银白色金属附着;
③由两个反应可知,得到电子的物质为氧化剂,还原剂对应的产物为氧化产物,氧化剂的氧化性大于氧化产物的氧化性,则氧化性为Ag+>Cu2+>Fe2+,
故答案为:Ag+>Cu2+>Fe2+;
(2)硝酸具有强氧化性,H2S具有较强还原性,二者发生氧化还原反应,故NO为还原产物、S为氧化产物,若反应过程中转移了0.3mol电子,由电子转移守恒,可知生成S的物质的量为:![]() =0.15mol,生成S的质量为:0.15mol×32g/mol=4.8g,
=0.15mol,生成S的质量为:0.15mol×32g/mol=4.8g,
故答案为:NO;4.8;
(3)一种氧化剂与多种还原剂反应时,先与还原性强的反应,将少量Cl2通入FeBr2的溶液中,反应的离子方程式为:2Fe2++Cl2===2Fe3++2Cl-,Fe2+被氧化,Br-没有被氧化,则还原性:Fe2+>Br-,还原剂的还原性大于还原产物的还原性,Fe2+>Cl-,
故答案为:Fe2+>Br->Cl-;

【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。己知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
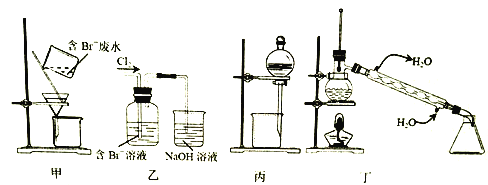
下列说法正确的是
A. 用甲装置过滤时,需不断搅拌
B. 丙装置中用正十二烷而不用CCl4,是因为其密度小
C. 用乙装置将Br-氧化为Br2
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2