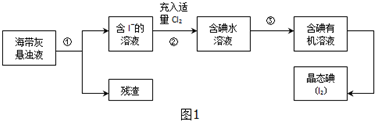
题目内容
13.下面各组物质中,通入的气体既作氧化剂又作还原剂的是( )| A. | Cl2通入石灰水中 | B. | CO2通入过氧化钠中 | ||
| C. | NO2通入水中 | D. | SO2通入水中 |
分析 气体中元素的化合价既升高又降低,则气体既作氧化剂又作还原剂,以此来解答.
解答 解:A.反应生成氯化钙、次氯酸钙、水,Cl元素的化合价既升高又降低,则气体既作氧化剂又作还原剂,故A选;
B.反应生成碳酸钠和氧气,只有过氧化钠中O元素的化合价变化,则气体既不作氧化剂又不作还原剂,故B不选;
C.发生3NO2+H2O=2HNO3+NO中,N元素的化合价由+4价变为+5价和+2价,气体既作氧化剂又作还原剂,故C选;
D.反应生成亚硫酸,没有元素的化合价变化,不属于氧化还原反应,故D不选;
故选AC.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.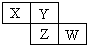 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法正确的是( )| A. | X的气态氢化物比Y的稳定 | |
| B. | W的最高价氧化物对应水化物的酸性比Z的强 | |
| C. | Z的非金属性比Y的强 | |
| D. | Y的氢化物只有一种 |
4.一定条件下的密闭容器内发生4NH3+5O2?4NO+6H2O的反应,下列反应速率关系正确的是( )
| A. | V${\;}_{N{H}_{3}}$=$\frac{4}{5}$V${\;}_{{O}_{2}}$ | B. | V${\;}_{N{H}_{3}}$=V${\;}_{{O}_{2}}$=V${\;}_{{H}_{2}O}$ | ||
| C. | V${\;}_{{O}_{2}}$=$\frac{4}{5}$VNO | D. | V${\;}_{{O}_{2}}$=$\frac{6}{5}$V${\;}_{{H}_{2}O}$ |
8.下列关于S、SO2、H2SO4的叙述中,正确的是( )
| A. | 硫是一种易溶于水的黄色晶体 | |
| B. | SO2溶于水生成H2SO4 | |
| C. | 用氢氧化钠溶液处理含有SO2的尾气 | |
| D. | 浓H2SO4不稳定,光照易分解 |
18.下列互为同位素的一组是( )
| A. | 氕、氘、氚 | B. | 白磷、红磷 | C. | 金刚石、石墨、C60 | D. | O2、O3 |
5.下列过程中放出热量的是( )
| A. | 铝投入盐酸中 | B. | 液态水变成水蒸气 | ||
| C. | 煅烧石灰石生成生石灰和二氧化碳 | D. | 氧分子变成氧原子 |
2.下列物质属于共价化合物的是( )
| A. | C60 | B. | CaCl2 | C. | KF | D. | C4H10 |
3.如图是高温下某反应的微观过程.下列说法中正确的是( )
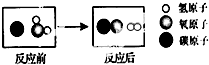

| A. | 该反应属于复分解反应 | B. | 该反应中元素的化合价没有变化 | ||
| C. | 图中的两种化合物都属于氧化物 | D. | 该反应所得生成物的质量比为1:1 |