题目内容
17.某化学兴趣小组要完成中和热的测定.(1)实验桌上备有烧杯(大小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、量筒、0.5mol•L-1 盐酸、0.55mol•L-1NaOH溶液,实验尚缺少的两种玻璃用品是温度计和环形玻璃搅拌棒.
(2)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(1)测出的△H偏大(填“偏大”、“偏小”或“不变”).
(3)为了测其酸碱反应的中和热,计算时至少需要的数据是C(填字母)
①酸的浓度和体积②碱的浓度和体积
③比热容 ④反应后溶液的质量
⑤生成水的物质的量 ⑥反应前后温度变化
⑦操作所需的时间
A.①②③⑥B.①③④⑤C.③④⑤⑥D.全部.
分析 (1)根据中和热测定的实验步骤选用需要的仪器烧杯(大小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、量筒、酸、碱溶液、温度计和环形玻璃搅拌棒,然后判断还缺少的仪器;
(2)醋酸是弱酸,电离过程需要吸热,中和反应是放热的,焓变是负值;
(3)根据中和热的计算公式△H=Q=-cm△T来确定实验中需要的数据.
解答 解:(1)中和热测定的实验步骤选用需要的仪器有:烧杯(大小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、量筒、盐酸、NaOH溶液、温度计和环形玻璃搅拌棒,
故答案为:温度计和环形玻璃搅拌棒;
(2)醋酸是弱酸,电离过程需要吸热,但中和反应是放热的,焓变是负值,若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(1)测出的△H偏大,
故答案为:偏大;
(3)根据反应热的计算公式△H=Q=-cm△T可知,酸碱反应的中和热计算时,至少需要的数据有:比热容c、反应后溶液的质量以及生成水的物质的量m、反应前后温度,根据反应前后的温度获得反应前后温度变化△T,故选C.
点评 本题考查学生中和热的测定实验知识,属于教材知识的考查,较简单.

练习册系列答案
相关题目
7.设NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | 1mol氯气参加氧化还原反应,转移的电子数一定为2 NA | |
| B. | 0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3NA | |
| C. | 常温常压下,44g二氧化碳分子中所形成的共用电子对数为4NA | |
| D. | 常温常压下,1.6gO2和O3混合气体中质子总数为0.8NA |
8.设阿伏加德罗常数的值为NA,下列说法中正确的是( )
| A. | 1mol苯乙烯中含有的C=C数为4NA | |
| B. | 1mol甲醇中含有C-H键的数目为4NA | |
| C. | 0.1molCnH2n+2中含有的C-C键数为0.1NA | |
| D. | 1molC4H10中含有共用电子对数是13NA |
5.下列电子式,正确的是( )
| A. | 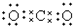 | B. | K+[••∙∙••••O∙∙∙∙O••∙∙H]- | ||
| C. | 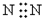 | D. |  |
12.能与Fe3+反应,且能证明Fe3+具有氧化性的是( )
①SCN- ②Fe ③Fe2+ ④Cu ⑤OH-.
①SCN- ②Fe ③Fe2+ ④Cu ⑤OH-.
| A. | ①②③④⑤ | B. | ①②④⑤ | C. | ②④ | D. | ④⑤ |
2.已知甲苯的一氯代物的同分异构体共有4种,则甲基环己烷的一氯代物的同分异构体共( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
9.加热的条件下,铝与下列溶液作用产生H2的是( )
| A. | 浓硫酸 | B. | 浓硝酸 | C. | 稀硝酸 | D. | NaOH溶液 |
6.10mL某气态烃,在50mL氧气中充分燃烧,得到液态水和35mL气体(气体体积均在同温同压下测定)此烃可能是( )
| A. | C2H6 | B. | C4H8 | C. | C3H8 | D. | C3H6 |