题目内容
13.下列说法中,不正确的是( )| A. | 硫既可做氧化剂,又可做还原剂 | B. | SO3只有氧化性 | ||
| C. | 可以用铁罐贮运冷的浓H2SO4 | D. | H2S既有氧化性又有还原性 |
分析 A.根据S元素的化合价分析;
B.最高价有氧化性,最低价有还原性;
C.常温下铁遇浓硫酸钝化;
D.最高价有氧化性,最低价有还原性.
解答 解:A.硫单质中S的化合价为0,处于中间价态,既可做氧化剂,又可做还原剂,故A正确;
B.SO3中S为+6价,只有氧化性,O元素为-2价只有还原性,所以SO3既有氧化性又有还原性,故B错误;
C.常温下铁遇浓硫酸钝化,所以可以用铁罐贮运冷的浓H2SO4,故C正确;
D.H2S中S元素处于最低价,有还原性,H元素处于最高价只有氧化性,所以H2S既有氧化性又有还原性,故D正确.
故选B.
点评 本题考查氧化还原反应,明确元素的化合价降低表现氧化性,并准确判断S元素的化合价变化是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
1.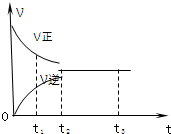 如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是( )
 如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,只有正方向反应 | B. | t2时,反应到达限度 | ||
| C. | t2-t3,反应不再发生 | D. | t2-t3,各物质的浓度还在发生变化 |
8.设阿伏加德罗常数的值为NA,下列说法中正确的是( )
| A. | 1mol苯乙烯中含有的C=C数为4NA | |
| B. | 1mol甲醇中含有C-H键的数目为4NA | |
| C. | 0.1molCnH2n+2中含有的C-C键数为0.1NA | |
| D. | 1molC4H10中含有共用电子对数是13NA |
18.在常温下向盛满水并倒置于水槽中的试管里先后通入4mL NO2、4 mL NO、5mL O2,经过一段时间后,试管里剩余的气体有( )
| A. | NO | B. | O2 | C. | NO2和O2 | D. | NO和O2 |
5.下列电子式,正确的是( )
| A. | 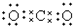 | B. | K+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H]- | ||
| C. | 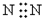 | D. |  |
2.已知甲苯的一氯代物的同分异构体共有4种,则甲基环己烷的一氯代物的同分异构体共( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
3.已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子排布相同,则下列关系式正确的是( )
| A. | a=b+m-n | B. | a=b-m+n | C. | a-m=b+n | D. | a-m=b-n |
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题: