题目内容
12.已知:①A 是石油裂解气的主要成分,A的产量通常有来衡量一个国家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH
③已知乳酸F的结构简式为
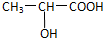
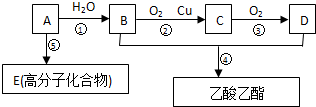
现以A为主要原料合成乙酸乙酯及高分子化合物E,其合成路线如图所示
回答下列问题:
(1)E的结构简式为
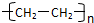
(2)F分子中含羟基和羧基两种官能团(写名称).
(3)验证D和F兼有的官能团采用的试剂是碳酸钠溶液或紫色石蕊试液,产生的现象为有气泡产生或溶液变红色.
(4)写出下列下列反应的反应类型:①加成反应④酯化反应或取代反应
(5)写出下列反应的化学方程式:
①A→BCH2=CH2+H2O$→_{△}^{催化剂}$C2H5OH
②A→E

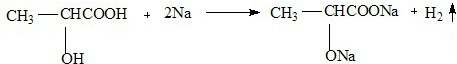
③F与金属钠反应的化学方程式:
 .
.
分析 A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,与水发生加成反应生成B为CH3CH2OH,乙醇氧化生成C为CH3CHO,CH3CHO进一步氧化可得D为CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成CH3COOCH2CH3,乙烯发生加聚反应生成高分子化合物E,则B为CH3CH2OH,C为CH3CHO,D为CH3COOH,E应为 ,F是乳酸,乳酸中含有羧基和醇羟基,具有醇和羧酸性质,据此分析解答.
,F是乳酸,乳酸中含有羧基和醇羟基,具有醇和羧酸性质,据此分析解答.
解答 解:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,与水发生加成反应生成B为CH3CH2OH,乙醇氧化生成C为CH3CHO,CH3CHO进一步氧化可得D为CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成CH3COOCH2CH3,乙烯发生加聚反应生成高分子化合物E,则B为CH3CH2OH,C为CH3CHO,D为CH3COOH,E应为 ,
,
(1)通过以上分析知,E结构简式为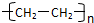 ,故答案为:
,故答案为: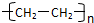
;
(2)F中官能团有醇羟基和羧基,故答案为:羟基;羧基;
(3)D和F中都含有羧基,都能和碳酸钠溶液反应生成气体,都能使紫色石蕊试液变蓝色,所以可以用碳酸钠溶液或紫色石蕊试液检验羧基,看到的现象是有气泡产生或溶液变红色,
故答案为:碳酸钠溶液或紫色的石蕊试液;有气泡产生或溶液变红色;
(4)①④反应类型分别是加成反应、酯化反应或取代反应,
故答案为:加成反应;酯化(取代)反应;
(5)①A生成B的反应为乙醇和水的加成反应,反应方程式为CH2=CH2+H2O$→_{△}^{催化剂}$ C2H5OH,
②A生成E的反应为乙烯的加聚反应,反应方程式为 ;
;
③F中醇羟基和羧基都与钠反应生成氢气,该反应方程式为 ,
,
故答案为:CH2=CH2+H2O$→_{△}^{催化剂}$ C2H5OH; ;
; .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,根据反应条件及题给信息进行推断,明确官能团及其性质关系,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案△H=-Q2kJ•mol-1. Q1、Q2、Q3均为正值.下列说法正确的是( )
| A. | 1 mol R(g)的能量总和大于1 mol M(s)与1 mol N(g) 的能量总和 | |
| B. | 将2 mol R (g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ | |
| C. | 当1 mol M(s) 与N(g)完全转化为T (g)时(假定无热量损失),放出热量Q1+$\frac{{Q}_{2}}{2}$kJ | |
| D. | M(g)+N(g)?R(g)△H=-Q3 kJ•mol-1,则Q3<Q1 |
| A. | 轮船底部焊上锌块可减级船体腐蚀,这种方法称为粞牲阳极的阴极保护法 | |
| B. | 精炼铜时,与电源负极相连的是纯铜,电极反应式为:Cu2++2e-═Cu | |
| C. | 镀层破损后,镀锌铁板比镀锡铁板更耐腐蚀 | |
| D. | 恒温下,用惰性电极电解饱和Na2CO3溶液,溶液浓度变大,有晶体析出 |
| A. | 在101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ热量,H2的燃烧热为-285.8kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 | |
| C. | 在101k Pa时,1mol C与适量O2 反应生成1mol CO时,放出110.5kJ热量,则C的燃烧热为110.5kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l),△H=-57.31 kJ•mol-1.若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ |
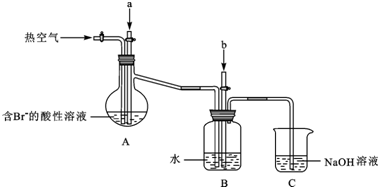
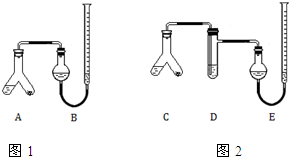 某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去.
某实验小组分别用图1、2装置测定某种钙片中碳酸钙的含量,夹持装置已略去.
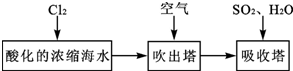
 .
.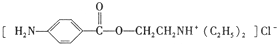 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下: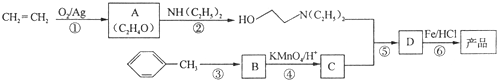
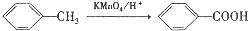
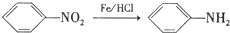
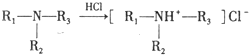
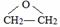 .
.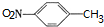 ,C中含氧官能团的名称为硝基、羧基.
,C中含氧官能团的名称为硝基、羧基.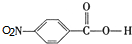 +HOCH2CH2N(C2H5)2 $\stackrel{一定条件下}{→}$
+HOCH2CH2N(C2H5)2 $\stackrel{一定条件下}{→}$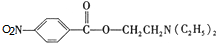 +H2O.
+H2O.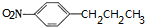 (任写一种).
(任写一种).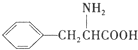 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式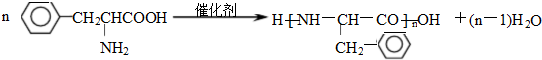 .
.