题目内容
14.某饱和醇1mol与O2气充分燃烧产生标况下44.8L的CO2气体,另取1mol该醇与足量的Na反应,收集到标况下22.4L的气体,则该醇为( )| A. | CH4O | B. | CH3CH2OH | C. |  | D. | 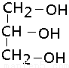 |
分析 根据n=$\frac{V}{{V}_{m}}$计算二氧化碳、氢气的物质的量,根据C原子守恒计算饱和醇分子中C原子数目,根据H原子守恒计算醇分子中-OH数目,可以且饱和醇的分子式,结合选项中结构简式判断.
解答 解:二氧化碳物质的量为$\frac{44.8L}{22.4L/mol}$=2mol,根据C原子守恒,可知饱和醇分子中C原子数目为$\frac{2mol}{1mol}$=2,与钠反应生成氢气为$\frac{22.4L}{22.4L/mol}$=1mol,根据H原子守恒,可知醇分子中-OH数目为$\frac{1mol×2}{1mol}$=2,故该饱和醇的结构简式为 ,故选C.
,故选C.
点评 本题考查有机物分子式与结构的确定,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
5. “低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.
“低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.
I. 用电弧法合成的储氢纳米碳管,可用如下氧化法提纯,请完成下述反应:
5 C+4 KMnO4+6 H2SO4→5CO2↑+4MnSO4+2K2SO4+6 H2O
II.某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,得到如表数据:
(1)实验I中,前5min的反应速率υ(CO2)=0.1mol•L-1•min-1.
(2)下列能判断在800℃实验条件下CO(g)与H2O(g)反应一定达到平衡状态的是D.
A.容器内压强不再变化 B.$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$=2
C.混合气体密度不变 D.υ正(CO)=υ逆(CO2)
(3)实验III中:y=1.
(4)Ⅲ的若实验容器改为在绝热的密闭容器中进行,实验测得H2O(g)的转化率a(H2O)随时间变化的示意图,如图所示,b点:υ正>υ逆(填“<”.“=”或“>”).
 “低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.
“低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.I. 用电弧法合成的储氢纳米碳管,可用如下氧化法提纯,请完成下述反应:
5 C+4 KMnO4+6 H2SO4→5CO2↑+4MnSO4+2K2SO4+6 H2O
II.某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,得到如表数据:
| 实验组 | 温度/℃ | 起始量(mol) | 平衡量(mol) | 达到平衡所需要时间/min | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | |||
| I | 800 | 2 | 2 | x | 1 | 5 |
| II | 900 | 1 | 2 | 0.5 | 0.5 | tm |
| III | 900 | 2 | 4 | y | y | tn |
(2)下列能判断在800℃实验条件下CO(g)与H2O(g)反应一定达到平衡状态的是D.
A.容器内压强不再变化 B.$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$=2
C.混合气体密度不变 D.υ正(CO)=υ逆(CO2)
(3)实验III中:y=1.
(4)Ⅲ的若实验容器改为在绝热的密闭容器中进行,实验测得H2O(g)的转化率a(H2O)随时间变化的示意图,如图所示,b点:υ正>υ逆(填“<”.“=”或“>”).
2.某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L-1 盐酸、0.55mol•L-1NaOH溶液,
尚缺少的实验玻璃用品是量筒、温度计.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?否(填“能”或“否”),其原因是金属易导热,热量散失导致误差大.
(3)他们记录的实验数据如下:
已知:Q=Cm(t2-t1),反应后溶液的比热容C为4.18KJ•℃-1•Kg-1,各物质的密度均为1g•cm-3.计算完成上表.
(4)实验中NaOH的浓度比HCl的大,其原因是确保盐酸完全反应,使反应更充分
(5)若用KOH代替NaOH,对测定结果无(填“有”或“无”)影响;若用醋酸代替HCl做实验,则测定结果偏低(填“偏高”“偏低”或“无影响”).
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5mol•L-1 盐酸、0.55mol•L-1NaOH溶液,
尚缺少的实验玻璃用品是量筒、温度计.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?否(填“能”或“否”),其原因是金属易导热,热量散失导致误差大.
(3)他们记录的实验数据如下:
| 实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
(4)实验中NaOH的浓度比HCl的大,其原因是确保盐酸完全反应,使反应更充分
(5)若用KOH代替NaOH,对测定结果无(填“有”或“无”)影响;若用醋酸代替HCl做实验,则测定结果偏低(填“偏高”“偏低”或“无影响”).
9.下列说法正确的是( )
| A. | 离子化合物不可以含共价键 | |
| B. | 含有共价键的化合物不一定是共价化合物,但是共价化合物只能含有共价键 | |
| C. | 共价化合物可以含离子键 | |
| D. | 离子键、共价键、金属键和氢键都是化学键 |
3.下列各离子方程式中,不属于水解反应的是( )
| A. | HCO3-+H2O?H3O++CO32- | B. | NH4++H2O?NH3•H2O+H+ | ||
| C. | PO43-+H2O═HPO42-+OH- | D. | NH3+H2O?NH4++OH- |
4.下列物质属于含有共价键的离子化合物的是( )
| A. | C2H2 | B. | KOH | C. | NaF | D. | C60 |
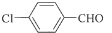 ; F的分子式为C7H4O3Na2;
; F的分子式为C7H4O3Na2;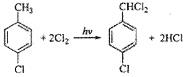 ,该反应类型为取代反应;
,该反应类型为取代反应;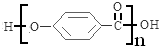 .
.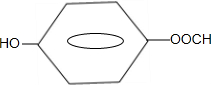 .
.