题目内容
14.在MnO2和浓盐酸的反应中,如果有17.4g MnO2被还原,那么参加反应的氯化氢有多少克?被氧化的氯化氢物质的量是多少?(已知:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O)分析 由方程式可知,当有1molMnO2参加反应,有4molHCl参加反应,但生成1molCl2,说明有2molHCl被氧化,n(MnO2)=$\frac{17.4g}{87g/mol}$=0.2mol,结合反应的方程式计算.
解答 解:n(MnO2)=$\frac{17.4g}{87g/mol}$=0.2mol,
MnO2 +4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O 被氧化HCl
1 4 2
0.2mol 0.8mol 0.4mol
则参加反应的HCl的物质的量为0.8mol,质量为0.8mol×36.5g/mol=29.2g,
由以上分析可知,被氧化的氯化氢的质量为0.4mol×36.5g/mol=14.6g,
答:参加反应的氯化氢有29.2g,被氧化的氯化氢物质的量是14.6g.
点评 本题考查氧化还原反应的相关计算,侧重于学生的分析能力和计算能力的考查,注意把握元素的化合价的变化,为解答该题的关键,答题注意注意结合方程式计算,难度不大.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
4.右图是元素周期表的一部分,关于图中阴影部分元素的说法中,正确的是( )
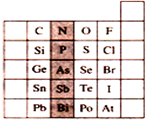

| A. | PH3的沸点比NH3高 | |
| B. | PH3的稳定性比H2S强 | |
| C. | 该纵行元素的最高价氧化物对应的水化物化学式均为H3RO4 | |
| D. | H3AsO4的酸性比H3PO4弱 |
2.下列说法正确的是( )
| A. | 由分子组成的物质中一定存在共价键 | |
| B. | 由非金属元素组成的化合物一定是共价化合物 | |
| C. | 非极性键只存在双原子分子中 | |
| D. | 两个非金属元素原子间不可能形成离子键 |
9.100 mL 1 mol•L-1的盐酸与锌粒反应,下列措施能使反应速率加快的是( )
①升高温度
②改用100mL 3mol•L-1的盐酸
③改用300mL 1mol•L-1的盐酸
④改用等量的锌粉代替.
①升高温度
②改用100mL 3mol•L-1的盐酸
③改用300mL 1mol•L-1的盐酸
④改用等量的锌粉代替.
| A. | ①③④ | B. | ①②③ | C. | ②③④ | D. | ①②④ |
6.下列说法正确的是( )
| A. | 除去乙烯中混有的甲烷,可将混合气体通过酸性高锰酸钾溶液 | |
| B. | 含有醛基和羰基的有机物都能跟银氨溶液发生银镜反应 | |
| C. | 苯乙烯分子中所有原子可能在一个平面上 | |
| D. | 甲酸分子中有醛基,因此无法区别甲醛溶液和甲酸溶液 |
3.下列分子式表示的物质,有两种同分异构体的是( )
| A. | C3H8 | B. | C3H7Cl | C. | CH2Cl2 | D. | C2H6O |
 若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答:
若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池,试回答: