题目内容
19.短周期元素W、X、Y的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、原子的核外内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质.根据以上叙述,下列说法中一定正确的是( )| A. | 上述三种元素的原子半径大小为Y<X<W | |
| B. | W、X、Y原子的核外最外层电子数的总和为10 | |
| C. | 由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 | |
| D. | W与Y只能形成含极性共价键的化合物 |
分析 X的一种核素在考古时常用来鉴定一些文物的年代,用的是C14;工业上采用液态空气分馏方法来生产Y的单质,这是工业上生产氮的方法,则Y为N元素,W的阴离子的核外电子数与X、Y原子的核外内层电子数相同,则W的阴离子核外有2个电子,所以W是H,结合元素周期律的递变规律解答该题.
解答 解:X的一种核素在考古时常用来鉴定一些文物的年代,用的是C14;工业上采用液态空气分馏方法来生产Y的单质,这是工业上生产氮的方法,则Y为N元素,W的阴离子的核外电子数与X、Y原子的核外内层电子数相同,则W的阴离子核外有2个电子,所以W是H,则
A.X为C,Y为N,同周期元素从左到右元素的原子半径逐渐减小,则原子半径C>N,H原子的半径最小,则原子半径:C>N>H,故A错误;
B.W、X、Y原子的核外最外层电子数的总和为1+4+5=10,故B正确;
C.W为H元素,X为C元素,Y为N元素,C和H可形成多种烃类化合物,当相对分子质量较大时,形成的烃在常温下为液体或固体,沸点较高,大于W与Y组成的化合物的沸点,故C错误;
D.W与Y可形成N2H4的化合物,既含极性共价键又含非极性共价键,故D错误.
故选B.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,本题注意正确推断元素的种类为解答该题的关键,注意碳氢化合物的种类以及性质.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列关于有机物的叙述正确的是( )
| A. | 石油液化气、汽油和石蜡的主要成分都是碳氢化合物 | |
| B. | 1,2-二氯乙烷在NaOH水溶液中发生消去反应得到乙炔 | |
| C. | 由CH2=CHCOOCH3合成的聚合物为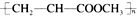 | |
| D. | 有机物中一定含有碳氢元素,可能含有氯、氧、硫等元素 |
7. 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图:下列对该化合物叙述正确的是( )
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图:下列对该化合物叙述正确的是( )
 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图:下列对该化合物叙述正确的是( )
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图:下列对该化合物叙述正确的是( )| A. | 属于芳香烃 | B. | 不能发生取代反应 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 在一定条件下可以发生加成反应 |
14.有机物分子中原子间或原子团间可以产生相互影响,从而导致化学性质的不同,以下事实不能说明此观点是( )
| A. | ClCH2COOH的酸性比CH3COOH酸性强 | |
| B. | 丙酮分子(CH3COCH3)中的氢原子比乙烷分子中的氢原子更易发生卤代反应 | |
| C. | HOOCCH2CHO既能发生银镜反应又能发生酯化反应 | |
| D. | 苯酚能与NaOH溶液反应而乙醇则不能 |
4.右图是元素周期表的一部分,关于图中阴影部分元素的说法中,正确的是( )
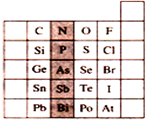

| A. | PH3的沸点比NH3高 | |
| B. | PH3的稳定性比H2S强 | |
| C. | 该纵行元素的最高价氧化物对应的水化物化学式均为H3RO4 | |
| D. | H3AsO4的酸性比H3PO4弱 |
11.在密闭容器中进行反应:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A. | Z为0.3 mol•L-1 | B. | Y2为0.4 mol•L-1 | C. | X2为0.2 mol•L-1 | D. | Z为0.4 mol•L-1 |
8.玻尔理论不能解释( )
| A. | H原子光谱为线状光谱 | |
| B. | 在一给定的稳定轨道上,运动的核外电子不发射能量----电磁波 | |
| C. | H原子的可见光区谱线 | |
| D. | H原子光谱的精细结构 |
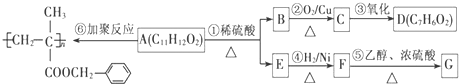
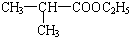 .
. .
.