题目内容
【题目】(1)标准状况下,4.48 L NH3所含分子数为____________。___molCO2中含有氧原子数与1.806×1024个H2O分子含有的氧原子数相同
(2) 1.7g H2O2中含有氧原子的物质的量为 _________mol,电子数目为 _____,已知ag H2O2中含原子数为b,则阿伏伽德罗常数为 _________(用含a、b的代数式表示)
(3)8.4 g N2与9.6 g某单质Rx,所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是_______,x值为_______。并写出R原子的原子结构示意图_________
(4)标况下等质量的O2与O3的体积之比为 ______,氧原子个数之比为 ______。
(5)在一密闭容器中充入a molNO和b molO2,可发生如下反应 2NO+O2=2NO2,充分反应后容器中氮原子和氧原子的个数之比__________
【答案】0.2NA 1.5 0.1 1.8NA ![]() 48 3
48 3 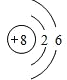 3:2 1:1
3:2 1:1 ![]()
【解析】
(1)依据n=![]() =
=![]() =
=![]() 计算解答;
计算解答;
(2) 根据n=![]() 计算分子的物质的量,再计算原子的物质的量和质子数;
计算分子的物质的量,再计算原子的物质的量和质子数;
(3) 依据N=nNA,分子数之比等于物质的量之比,据此计算Rx的式量;依据8.4g N2与9.6g某单质Rx,所含原子个数相同计算x值,然后求出质子数,写出原子结构示意图;
(4) 根据n=![]() 、N=
、N=![]() ×NA及分子构成计算;
×NA及分子构成计算;
(5) 无论NO和氧气是否完全反应,即无论容器中存在的微粒是什么,但密闭容器中各种元素原子个数不变,据此计算出反应后容器中氮原子和氧原子的个数之比
(1) 4.48L NH3所含分子数为:![]() ×NA=0.2NA;1.806×1024个H2O分子含有的氧原子的物质的量为
×NA=0.2NA;1.806×1024个H2O分子含有的氧原子的物质的量为![]() =3mol,含有的氧原子数相同的CO2的物质的量为
=3mol,含有的氧原子数相同的CO2的物质的量为![]() =1.5mol;
=1.5mol;
(2)1.7gH2O2中含有O原子的物质的量为![]() ×2mol=0.1mol,含有的质子数为0.1mol×18×NA=1.8NA;已知agH2O2中含原子数为b,则
×2mol=0.1mol,含有的质子数为0.1mol×18×NA=1.8NA;已知agH2O2中含原子数为b,则![]() ×4×NA=b,所以阿伏伽德罗常数数值NA=
×4×NA=b,所以阿伏伽德罗常数数值NA=![]() ;
;
(3)设Rx的式量为X,8.4g N2与9.6g某单质Rx,分子数之比为3:2,所以![]() :
:![]() ,解得:X=48;8.4g N2与9.6g某单质Rx,所含原子个数相同,则:
,解得:X=48;8.4g N2与9.6g某单质Rx,所含原子个数相同,则:![]() ×2=
×2=![]() ×xspan>,解得:x=3,则R的相对原子质量为
×xspan>,解得:x=3,则R的相对原子质量为![]() =16,为氧元素,氧原子内有8个质子,核外有2个电子层,分别容纳2、6个电子,其原子结构示意图:
=16,为氧元素,氧原子内有8个质子,核外有2个电子层,分别容纳2、6个电子,其原子结构示意图: ;
;
(4) 设O2和O3的质量都为m,根据n=![]() ,O2和O3的物质的量之比为
,O2和O3的物质的量之比为![]() :
:![]() =3:2,根据N=
=3:2,根据N=![]() ×NA,则所含分子个数之比为3:2,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以其原子个数比为:(3×2):(2×3)=1:1;
×NA,则所含分子个数之比为3:2,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以其原子个数比为:(3×2):(2×3)=1:1;
(5) 无论NO和氧气是否完全反应,即无论容器中存在的微粒是什么,但密闭容器中各种元素原子个数不变;根据N=nNA知,各种元素的原子个数之比等于其物质的量之比,![]() 。
。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】对下列实验事实的理论解释错误的是( )
选项 | 实验事实 | 理论解释 |
A | 酸性:H2SO4>H2SO3 | H2SO4非羟基氧原子个数大于H2SO3,中心原子正电性越高,酸性越强 |
B | Be单质能溶于KOH溶液 | Be和Al在周期表中是对角线关系,性质相似 |
C | Al原子的第一电离能大于Mg原子 | Mg的金属性比Al强,更容易失去电子 |
D | 沸点:对羟基苯甲醛>邻羟基苯甲醛 | 对羟基苯甲醛存在分子间氢键,邻羟基苯甲醛存在分子内氢键,分子间氢键对它们沸点的影响大于分子内氢键对它们沸点的影响 |
A.AB.BC.CD.D