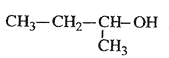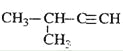题目内容
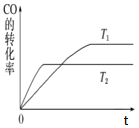
【题目】实验室可用二氧化锰跟浓盐酸反应制备并收集干燥纯净的氯气。进行此实验,所用仪器如图:
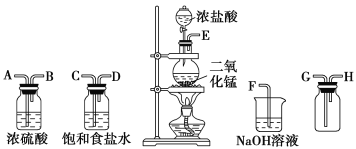
(1)连接上述仪器的正确顺序(填各接口处的字母):________接________;________接________;________接________;________接________。
(2)装置中,饱和食盐水的作用是__________;用湿润的淀粉KI试纸可检验是否有Cl2产生。若有Cl2产生,可观察到的现象是___________。
(3)写出该实验中气体发生装置中进行的反应的离子方程式________。有兴趣小组将实验制得的氯气通入热的KOH溶液,得到了KClO3,写出该反应的化学方程式______。
(4)该兴趣小组为比较Fe2+与I-还原性的强弱,向FeI2溶液中通入少量氯气,再向其中加入__________(填试剂化学式),充分振荡,下层溶液呈紫红色。已知氧化性Cl2强于Fe3+,请写出向FeI2溶液中通入过量氯气反应的离子方程式_________________________。
【答案】E C D A B G H F 除去Cl2中混有的HCl 试纸变蓝色 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 3Cl2 + 6KOH
Mn2++Cl2↑+2H2O 3Cl2 + 6KOH![]() KClO3 +5KCl +3H2O CCl4 2Fe2+ + 4I- + 3Cl2 = 2Fe3+ +2I2 +6Cl-
KClO3 +5KCl +3H2O CCl4 2Fe2+ + 4I- + 3Cl2 = 2Fe3+ +2I2 +6Cl-
【解析】
(1)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,需要发生装置生成氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,导气管长进短处收集氯气,最后用氢氧化钠溶液吸收多余的氯气;
(2)饱和食盐水是用来除去氯气中的氯化氢气体;氯气具有氧化性遇到淀粉碘化钾溶液会氧化碘离子为单质碘遇淀粉变蓝;
(3)发生装置中是二氧化锰和浓盐酸加热反应生成氯化锰、氯气与水;氯气与热的氢氧化钾溶液反应生成氯化钾、氯酸钾和水;
(4)碘化亚铁中加入过量氯气,发生氧化还原反应,完成化学方程式,选择萃取剂时看密度;
(1)氯气中混有氯化氢和水气,先通过饱和食盐水除去氯化氢,再通过浓硫酸干燥除水,最后用排空气法收集氯气,同时过量的氯气用NaOH溶液吸收,仪器的正确顺序为E接C,D接A,B接G,H接F;
(2)氯气溶于水是可逆反应,Cl2+H2O= HCl+HClO,饱和食盐水使平衡逆向移动,降低氯气在水中的溶解度,吸收氯化氢气体,用饱和食盐水除去Cl2中混有的HCl;氯气可氧化碘离子为单质碘,试纸变蓝色;
(3)反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,根据题意可得方程式为 3Cl2 + 6KOH
Mn2++Cl2↑+2H2O,根据题意可得方程式为 3Cl2 + 6KOH![]() KClO3 +5KCl +3H2O;
KClO3 +5KCl +3H2O;
(4)下层溶液显紫色,密度大于水,用CCl4 萃取反应生成的单质碘,下层溶液呈紫红色。氯气过量,既可以氧化亚铁离子,也可以氧化碘离子,因此方程式为2Fe2+ + 4I- + 3Cl2 = 2Fe3+ +2I2 +6Cl-。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案