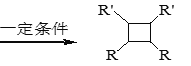
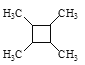
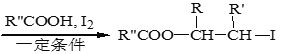题目内容
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
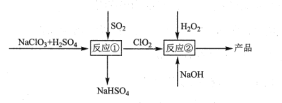
下列说法错误的是( )
A. 反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B. 若反应①通过原电池来实现,则ClO2是正极产物
C. 反应②中的H2O2可用NaClO2代替
D. 反应②条件下,ClO2的氧化性大于H2O2
【答案】C
【解析】
A选项,根据氧化还原反应原理,反应①阶段,NaClO3化合价降低1个价态,SO2化合价升高2个价态,根据升降守恒,则反应的NaClO3和SO2的物质的量之比为2:1,故A正确,不符合题意;
B选项,若反应①通过原电池来实现,ClO2是通过化合价降低得来,发生还原反应,因此ClO2是正极产物,故B正确,不符合题意;
C选项,反应②中H2O2化合价升高,ClO2与NaClO2是相邻价态,NaClO2的价态不可能升高,故C错误,符合题意;
D选项,反应②条件下,ClO2化合价降低得到NaClO2,作氧化剂,H2O2化合价升高,作还原剂,因此氧化性ClO2大于H2O2,故D正确,不符合题意。
综上所述,答案为C。

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目