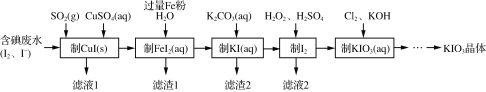
题目内容
【题目】某实验小组对KSCN的性质进行探究,设计如下实验:
试管中试剂 | 实验 | 滴加试剂 | 现象 |
| Ⅰ | ⅰ.先加1mL 0.1 mol/L FeSO4溶液 ⅱ.再加硫酸酸化的KMnO4溶液 | ⅰ.无明显现象 ⅱ.先变红,后褪色 |
Ⅱ | ⅲ.先加1mL 0.05 mol/L Fe2(SO4)3溶液 ⅳ.再滴加0.5 mL 0.5 mol/L FeSO4溶液 | ⅲ.溶液变红 ⅳ.红色明显变浅 |
(1)SCN-存在两种结构式,分别为N≡C—S-和S=C=N-,SCN-是二者的互变异构的混合物,请写出N≡C—S-的电子式__________。
(2)用离子方程式表示FeSO4溶液显酸性的原因__________。
(3)①用离子方程式表示实验Ⅰ溶液变红的原因____________________________。

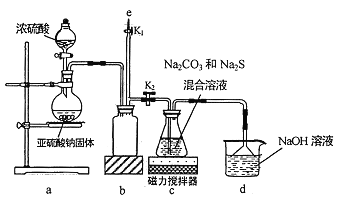
②针对实验Ⅰ中红色褪去的原因,小组同学认为是SCN-被酸性KMnO4氧化为SO42-,并设计如如图实验装置证实了猜想是成立的。其中X溶液是_______,Y溶液是_______,检验产物SO42-的操作及现象是_____________。
(4)针对实验Ⅱ“红色明显变浅”的现象,实验小组进行探究。
甲同学查资料得知:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使Fe3++SCN-![]() [Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
[Fe(SCN)]2+平衡体系中的Fe3+跟SCN-结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
乙同学认为SCN-可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN-![]() [Fe(SCN)]2+平衡左移,红色明显变浅,而Mg2+与SCN-难络合,于是乙设计了如下实验:
[Fe(SCN)]2+平衡左移,红色明显变浅,而Mg2+与SCN-难络合,于是乙设计了如下实验:

由此推测,实验Ⅱ“红色明显变浅”的原因是___________________。
(5)工业上测定钛铁合金中钛含量的其中一步反应原理是:以KSCN为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti(Ⅲ),反应的化学方程式为:Ti2(SO4)3+2NH4Fe(SO4)2===2Ti(SO4)2+(NH4)2SO4+2FeSO4,则达到滴定终点的实验现象是______。
【答案】![]() Fe2++2H2O
Fe2++2H2O![]() Fe(OH)2 + 2H+ MnO4—+ 5Fe2+ + 8H+ = Mn2++ 5Fe3+ + 4H2O,Fe3+ +3SCN—
Fe(OH)2 + 2H+ MnO4—+ 5Fe2+ + 8H+ = Mn2++ 5Fe3+ + 4H2O,Fe3+ +3SCN—![]() Fe(SCN)3 0.1 mol/L KSCN溶液 硫酸酸化的KMnO4溶液 一段时间后取少量反应后的KSCN溶液,先加盐酸酸化,再加氯化钡溶液,出现白色沉淀 水溶液的稀释使溶液变浅;“盐效应”使Fe3+跟SCN—结合成[Fe(SCN)] 2+的机会减少;SCN—与Fe2+反应生成无色络合离子,三者可能均有 无色变为红色或溶液变红
Fe(SCN)3 0.1 mol/L KSCN溶液 硫酸酸化的KMnO4溶液 一段时间后取少量反应后的KSCN溶液,先加盐酸酸化,再加氯化钡溶液,出现白色沉淀 水溶液的稀释使溶液变浅;“盐效应”使Fe3+跟SCN—结合成[Fe(SCN)] 2+的机会减少;SCN—与Fe2+反应生成无色络合离子,三者可能均有 无色变为红色或溶液变红
【解析】
(1)根据结构式即可写电子式;
(2)考查盐类水解;
(3)探究溶液变红后褪色原因,先变红是Fe2+氧化为Fe3+,Fe3+再与SCN—结合生成Fe(SCN)3。后褪色设计成原电池,从电子转移方向可判断正负极,结合化合价改变可判断电解质溶液;
(4)结合实验现象可知三次颜色都变浅,即都有关系;
(5)滴定终点会有铁离子,能跟指示剂反应。
(1)根据结构式N≡C—S-,可知电子式为![]() ;
;
(2)FeSO4是强酸弱碱盐,显酸性的原因是Fe2+的水解,离子方程式为:Fe2++2H2O![]() Fe(OH)2 + 2H+;
Fe(OH)2 + 2H+;
(3)①KMnO4将Fe2+氧化为Fe3+,Fe3+再与SCN—结合生成Fe(SCN)3,溶液变红,离子方程式为MnO4—+ 5Fe2+ + 8H+ = Mn2++ 5Fe3+ + 4H2O,Fe3+ +3SCN—![]() Fe(SCN)3;
Fe(SCN)3;
②探究SCN-是否被酸性KMnO4氧化为SO42-,设计成原电池,由电子转移方向可知,X溶液所处电极为负极,化合价升高,失去电子。故X溶液是0.1 mol/L KSCN溶液,Y溶液是硫酸酸化的KMnO4溶液。检验产物SO42-的操作及现象是:一段时间后取少量反应后的KSCN溶液,先加盐酸酸化,再加氯化钡溶液,出现白色沉淀;
(4)由三次加入试剂颜色均会变浅且一次比一次更浅可知,实验Ⅱ“红色明显变浅”的原因是水溶液的稀释使溶液变浅;“盐效应”使Fe3+跟SCN—结合成[Fe(SCN)] 2+的机会减少;SCN—与Fe2+反应生成无色络合离子,三者可能均有。
(5)以KSCN为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti(Ⅲ),反应的化学方程式为:Ti2(SO4)3+2NH4Fe(SO4)2===2Ti(SO4)2+(NH4)2SO4+2FeSO4,滴定终点有:Fe3+ +3SCN—![]() Fe(SCN)3,则达到滴定终点的实验现象是无色变为红色或溶液变红。
Fe(SCN)3,则达到滴定终点的实验现象是无色变为红色或溶液变红。

 小夫子全能检测系列答案
小夫子全能检测系列答案