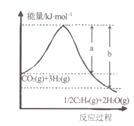
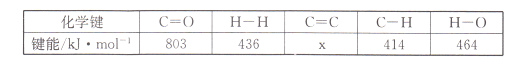
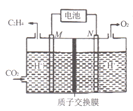
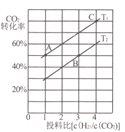
题目内容
【题目】影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。实验药品:铜、铁、镁、0.5 mol L-1H2SO4溶液、2 mol L-1 H2SO4溶液。甲同学研究的实验报告如下表∶
实验步骤 | 现象 | 结论 |
①分别取等体积的2 mol L-1 的硫酸溶液于三支试管中 | 反应速率∶ 镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
(1) 甲同学表中实验步骤②为______________________。
(2) 甲同学的实验目的是__________________________。
要得出正确的实验结论,还需要控制的实验条件是_____________。
乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行实验∶

(3)乙同学在实验中应该测定的数据是_________________。
(4)乙同学完成该实验应选用的实验药品是________________。
【答案】(1)分别投入大小、形状相同的铜、铁、镁(2)研究金属本身的性质与反应速率的关系 温度相同(3)一定时间内产生气体的体积(或产生一定体积的气体所需的时间)(4)镁(或铁)、0.5 mol L-1H2SO4溶液、2 molL-1H2SO4溶液
【解析】
(1)根据表中数据可以知道,硫酸的浓度相同,不同金属的规格相同,说明实验目的是探究反应物本身对反应速率的影响;
(2)根据表中内容可以知道,金属的活泼性是金属本身的性质,甲同学的实验目的是研究金属本身的性质与反应速率的关系,注意在实验中一定要控制反应在相同的温度下进行;
(3)金属和酸反应的速率可以通过单位时间内产生氢气的量的多少来确定;
(4)金属和不同浓度的酸反应,来确定浓度对反应速率的影响;
(1)根据表中的信息得出该同学的实验目的是研究反应物本身的性质对反应速率的关系对反应速率的影响,根据表中数据可以知道,硫酸的浓度相同,不同金属的规格应相同;
因此,本题正确答案是:分别投入大小、形状相同的Cu、Fe、Mg。
(2)根据表中的信息得出该同学的实验目的是研究反应物本身的性质对反应速率的关系对反应速率的影响,温度对化学反应速率的影响较大,故根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持温度相同;
因此,本题正确答案是: 研究金属本身的性质与反应速率的关系 温度相同。
(3)金属和酸反应的速率可以通过单位时间内产生氢气的量的多少来确定;
因此,本题正确答案是:一定时间内产生气体的体积(或产生一定体积的气体所需的时间)。
(4)乙同学想让同种金属如给定的金属镁或铁和不同浓的酸反应,来确定酸的浓度对反应速率的影响;
因此,本题正确答案是:镁(或铁)和0.5 mol L-1H2SO4溶液、2 molL-1H2SO4溶液。

【题目】已知七种短周期元素a~g的有关信息如下表所示:
元素编号 | a | b | c | d | e | f | g |
原子半径/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
最高化合价或最低化合价 | +1 | ﹣2 | +3 | ﹣2 | +3 | +1 | +1 |
下列推断不正确的是( )
A. 氢化物稳定性的强弱:b>dB. 金属性的强弱:f<g
C. 元素e的氧化物只能与酸反应D. 元素a与元素d形成的化合物属于共价化合物
【题目】已知25℃时有关弱酸的电离平衡常数:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 | H2SO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
(1)25℃时,将20mL 0.1mol·L-1CH3COOH溶液和20mL 0.1mol·L-1HSCN溶液分别与20mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:

反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:__________________________
(2)若保持温度不变,在CH3COOH溶液中加入一定量氨气,下列量会变小的是____(填序号)
A.c(CH3COO-) B.c(H+)C.Kw D.醋酸电离平衡常数
(3)若保持温度不变,将pH均为3的HCl与HSCN的溶液分别加水稀释100倍,此时c(Cl-)_____c(SCN-) (填“>、=、<”,后同),两溶液的导电性:HCl _______HSCN
(4)将足量的NaHSO3溶液加入Na2CO3溶液中,反应的离子方程式为___________________________