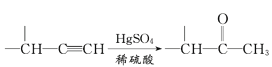
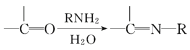
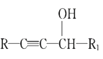题目内容
【题目】近年来,利用电化学催化方法进行CO2转化的研究引起了世界范围内的高度关注。下图是以Cu作为催化剂CO2转化为甲酸的反应过程,下列有关说法不正确的是

A.过程①说明在催化剂作用下,O-C-O之间形成了一种特殊的化学键
B.过程②和③吸收了能量并形成了O-H键和C-H键
C.CO2和HCOOH中均只含有极性共价键
D.每1molCO2完全转化为甲酸需得2mole-
【答案】B
【解析】
A.根据图示可知在CO2催化转化为HCOOH的过程①中,在O-C-O之间形成了一种特殊的化学键,A正确;
B.断裂化学键吸收能量,形成化学键释放能量,所以在过程②中CO2结合H+形成了O—H键,在过程③中-COOH与H+结合形成H-C键是释放能量,B错误;
C.在CO2分子中含有C=O极性共价键,在HCOOH中含有C-H、H-O、C-O、C=O极性共价键,C正确;
D.在CO2中C为+4价,在HCOOH中C为+2价,所以每1 mol CO2完全转化为甲酸需得2mol e-,D正确;
故答案选B。

练习册系列答案
相关题目