题目内容
下列措施能减慢化学反应速率的是( )
| A、将煤块粉碎后燃烧 |
| B、用2mol/L的盐酸代替0.1mol/L的盐酸反应制氢气 |
| C、用过氧化氢溶液制氧气时添加少量二氧化锰粉末 |
| D、将食物贮藏在冰箱中 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:减慢反应速率,可降低温度、减小浓度或减小固体的表面积等,以此解答.
解答:
解:A.固体表面积增大,反应速率增大,故A错误;
B.盐酸浓度增大,反应速率增大,故B错误;
C.加入催化剂,可增大反应速率,故C错误;
D.将食物贮藏在冰箱中,温度降低,反应速率减小,故D正确.
故选D.
B.盐酸浓度增大,反应速率增大,故B错误;
C.加入催化剂,可增大反应速率,故C错误;
D.将食物贮藏在冰箱中,温度降低,反应速率减小,故D正确.
故选D.
点评:本题考查反应速率的影响,为高频考点,侧重于基本理论的理解和应用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
下列除杂质的操作方法正确的是( )
| A、NH3中有少量的水蒸气:通过装有浓硫酸的洗气瓶 |
| B、氯化铵中含有碘单质:加热使碘单质升华 |
| C、NO中有少量的NO2:用水洗涤后再干燥 |
| D、KNO3溶液中有少量Ba(NO3)2:加过量的H2SO4,过滤除去沉淀 |
下列水溶液一定呈中性的是( )
| A、c(NH4+)=c(Cl-)的NH4Cl溶液 |
| B、c(H+)=1.0×10-7mol?L-1的溶液 |
| C、pH=7的溶液 |
| D、室温下将pH=3的酸与pH=11的碱等体积混合后的溶液 |
在容积固定的密闭容器中充入一定量的X、Y两种气体,一定条件下发生可逆反应3X(g)+Y(g)═2Z(g),并达到平衡.已知正反应是放热反应,测得X的转化率为37.5%,Y的转化率为25%,下列有关叙述正确的是( )
| A、若X的反应速率为0.2 mol?L-1?s-1,则Z的反应速率为0.3 mol?L-1?s-1 |
| B、若向容器中充入氦气,压强增大,Y的转化率提高 |
| C、升高温度,正反应速率减小,平衡向逆反应方向移动 |
| D、开始充入容器中的X、Y物质的量之比为2:1 |
设NA为阿伏加德罗常数的值,下列有关说法正确的是( )
| A、-OH与OH-含有的电子数相同 |
| B、1mol C3H8分子中含有的共价键数目为11NA |
| C、1mol碳正离子CH5+所含的电子数为10NA |
| D、标准状况下,22.4L CCl4中含有NA个碳原子 |
如图为铜-锌-稀硫酸构成的原电池示意图,下列说法错误的是( )
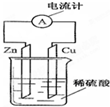

| A、负极反应式为:Zn-2e-═Zn2+ |
| B、正极反应式为:2H++2e-═H2↑ |
| C、电子由锌片通过导线流向铜片,再由铜片经电解质溶液流回锌片 |
| D、该装置能将化学能转变为电能 |
类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实验的验证.以下类推的结论正确的是( )
| A、由“Cl2+H2O═HCl+HClO”可推出“F2+H2O═HF+HFO” |
| B、HCl的水溶液是强酸,推出HF的水溶液也是强酸 |
| C、由“2Fe+3Cl2═2FeCl3”可推出“2Fe+3I2═2FeI3” |
| D、Na常温下与水剧烈反应,故K常温下也能与水剧烈反应 |
下列说法不正确的是( )
| A、苯和浓硫酸在70~80℃时发生磺化反应 | ||
| B、芳香烃是分子组成符合CnH2n-6(n≥6)的一类物质 | ||
| C、甲苯可以和浓硝酸与浓硫酸的混合物发生硝化反应 | ||
D、等质量的烃(CXHY)耗氧量取决于
|