题目内容
设NA为阿伏加德罗常数的值,下列有关说法正确的是( )
| A、-OH与OH-含有的电子数相同 |
| B、1mol C3H8分子中含有的共价键数目为11NA |
| C、1mol碳正离子CH5+所含的电子数为10NA |
| D、标准状况下,22.4L CCl4中含有NA个碳原子 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.羟基中含有9个电子,氢氧根离子中含有10个电子;
B.丙烷分子中含有2个碳碳键、8个碳氢键,总共含有10个共价键;
C.碳正离子中含有10个电子,1mol该碳正离子中含有10mol电子;
D.标准状况下,四氯化碳为液体,不能使用标况下的气体摩尔体积计算四氯化碳的物质的量.
B.丙烷分子中含有2个碳碳键、8个碳氢键,总共含有10个共价键;
C.碳正离子中含有10个电子,1mol该碳正离子中含有10mol电子;
D.标准状况下,四氯化碳为液体,不能使用标况下的气体摩尔体积计算四氯化碳的物质的量.
解答:
解:A.氢氧根离子的电子式为 ,氢氧根离子中含有10个电子,而羟基
,氢氧根离子中含有10个电子,而羟基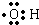 中含有9个电子,二者含有的电子数不同,故A错误;
中含有9个电子,二者含有的电子数不同,故A错误;
B.1mol丙烷中含有2mol碳碳键、8mol碳氢键,总共含有10mol共价键,含有的共价键数目为10NA,故B错误;
C.1mol碳正离子CH5+所含的电子的物质的量为10mol,含有的电子数为10NA,故C正确;
D.标况下四氯化碳不是气体,不能使用标况下的气体摩尔体积计算22.4L四氯化碳的物质的量,故D错误;
故选C.
 ,氢氧根离子中含有10个电子,而羟基
,氢氧根离子中含有10个电子,而羟基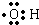 中含有9个电子,二者含有的电子数不同,故A错误;
中含有9个电子,二者含有的电子数不同,故A错误;B.1mol丙烷中含有2mol碳碳键、8mol碳氢键,总共含有10mol共价键,含有的共价键数目为10NA,故B错误;
C.1mol碳正离子CH5+所含的电子的物质的量为10mol,含有的电子数为10NA,故C正确;
D.标况下四氯化碳不是气体,不能使用标况下的气体摩尔体积计算22.4L四氯化碳的物质的量,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标准状况下四氯化碳、乙醇等不是气体;准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,选项C为易错点,注意该碳正离子中含有10个分子.

练习册系列答案
相关题目
下列各组物质变化时,所克服的微粒间的相互作用或作用力属同种类型的是( )
| A、碘的升华和NH4Cl的“升华” |
| B、冰的融化和石英的熔化 |
| C、NaCl熔化和NaOH溶于水 |
| D、溴的挥发和NH4HCO3的分解 |
下列物质属于纯净物的是( )
| A、空气 | B、碱石灰 | C、液氯 | D、海水 |
下列各组物质互为同系物的是( )
| A、金刚石和石墨 |
B、CH3-CH2-CH2-CH3和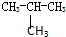 |
| C、CH4和C2H6 |
| D、16O和18O |
CH3CH2OH分别跟H18OOCC2H5和H16OOCC2H5酯化反应后,两者生成水的摩尔质量( )
| A、前者大 | B、前者小 |
| C、相等 | D、不能确定 |
下列措施能减慢化学反应速率的是( )
| A、将煤块粉碎后燃烧 |
| B、用2mol/L的盐酸代替0.1mol/L的盐酸反应制氢气 |
| C、用过氧化氢溶液制氧气时添加少量二氧化锰粉末 |
| D、将食物贮藏在冰箱中 |
下列除杂方法正确的是( )
| A、乙烷气体中混有乙烯,通入氢气,使乙烯发生加成反应 |
| B、氯化钠溶液中混有少量硫酸钠,加入适量硝酸钡溶液,过滤 |
| C、乙醇中混有乙酸,加入氢氧化钠后,分液 |
| D、二氧化碳气体中混有少量的二氧化硫,通入酸性高锰酸钾溶液 |
pH=11的NaOH溶液和pH=3的醋酸溶液以等体积混合后,所得溶液中c(Na+)和c(CH3COO-)?的正确关系是( )
| A、c(Na+)>c(CH3COO-)? |
| B、c(Na+)=c(CH3COO-)? |
| C、c(Na+)<c(CH3COO-)? |
| D、不能确定 |