题目内容
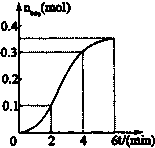 已知CaCO3与稀盐酸的反应为放热反应,取一定量的CaCO3与稀盐酸进行实验,生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
已知CaCO3与稀盐酸的反应为放热反应,取一定量的CaCO3与稀盐酸进行实验,生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A、反应开始后2~4分钟内平均反应速率最大 |
| B、反应刚开始时反应速率较小,然后逐渐增大 |
| C、反应前阶段速率逐渐增大,是因为反应放热,使反应速率加快 |
| D、生成物CaCl2、CO2和H2O的总能量比反应物CaCO3和盐酸的总能量高 |
考点:化学反应速率的影响因素,反应热和焓变
专题:化学反应中的能量变化,化学反应速率专题
分析:CaCO3与稀盐酸的反应为放热反应,随着反应的进行,温度逐渐升高,盐酸浓度逐渐降低,结合各时间段二氧化碳物质的量的变化可比较反应速率的大小,以此解答该题.
解答:
解:A.由图可知,2~4分钟时间内,生成的二氧化碳的体积最多,故2~4min反应速率最快,故A正确;
B.由图象可知,0~2分钟时间内,生成二氧化碳0.1mol,2~4分钟时间内,生成二氧化碳0.2mol,4~6分钟时间内,生成二氧化碳0.1mol,则反应刚开始时反应速率较小,然后逐渐增大,最后减小,故B错误;
C.随反应进行氢离子浓度降低,氢离子浓度变化使反应速率降低,由图象可知,2~4min反应速率最快,0~4分钟温度对反应速率起主要作用,4min后反应速率又降低,氢离子浓度起主要作用,故C正确;
D.反应为放热反应,说明反应物总能量大于生成物总能量,故D错误.
故选BD.
B.由图象可知,0~2分钟时间内,生成二氧化碳0.1mol,2~4分钟时间内,生成二氧化碳0.2mol,4~6分钟时间内,生成二氧化碳0.1mol,则反应刚开始时反应速率较小,然后逐渐增大,最后减小,故B错误;
C.随反应进行氢离子浓度降低,氢离子浓度变化使反应速率降低,由图象可知,2~4min反应速率最快,0~4分钟温度对反应速率起主要作用,4min后反应速率又降低,氢离子浓度起主要作用,故C正确;
D.反应为放热反应,说明反应物总能量大于生成物总能量,故D错误.
故选BD.
点评:本题考查反应速率的定量表示及有关图象,为高频考点,侧重于学生的分析能力的考查,难度中等,注意根据速率定义式进行理解,注意理解影响反应速率的因素.

练习册系列答案
相关题目
对体积不变的气体反应,升高温度时,化学反应速率加快,主要原因是( )
| A、分子运动速率加快,使反应物分子间的碰撞机会增多 |
| B、反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
| C、该反应的过程是吸热的 |
| D、该反应的过程是放热的 |
在下列五种物质的组合中,既能跟氢氧化钠溶液反应,又能跟盐酸反应,且在生成物中都有盐和水的是( )
①Al ②Al(OH)3 ③Al2O3 ④Na2CO3 ⑤NaHCO3 ⑥FeO.
①Al ②Al(OH)3 ③Al2O3 ④Na2CO3 ⑤NaHCO3 ⑥FeO.
| A、①②③ | B、①③⑤ |
| C、②③⑤ | D、②④⑤⑥ |
下列变化过程中,△S<0的是( )
| A、干冰升华 |
| B、CaCO3(s)分解为CaO(s)和CO2(g) |
| C、NH3(g)与HCl(g)反应生成NH4Cl(s) |
| D、氯化钠溶于水中 |
“绿色化学”是一个日渐为人们所熟悉的社会概念,绿色食品的基本标准是( )
①香甜可口 ②无污染 ③表面呈绿色 ④无化学添加剂 ⑤有营养价值.
①香甜可口 ②无污染 ③表面呈绿色 ④无化学添加剂 ⑤有营养价值.
| A、②④⑤ | B、①②③⑤ |
| C、①③④⑤ | D、全部 |
 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( ) A、B、C、D、E五种物质均含有同一种元素,它们之间的转化关系如图所示:
A、B、C、D、E五种物质均含有同一种元素,它们之间的转化关系如图所示: