题目内容
根据以下热化学方程式,回答问题:
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO2(g)+C(s)═2CO(g)△H=+172.46kJ/mol
(1)C的燃烧热为 ;
(2)写CO燃烧的热化学方程式 .
(3)在2L密闭容器中,充入1mol CO2气体和1mol 固体C混合反应,当反应达到平衡时,测得CO2的浓度为0.1mol/L,根据反应②计算该反应的平衡常数.(写出计算过程)
①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO2(g)+C(s)═2CO(g)△H=+172.46kJ/mol
(1)C的燃烧热为
(2)写CO燃烧的热化学方程式
(3)在2L密闭容器中,充入1mol CO2气体和1mol 固体C混合反应,当反应达到平衡时,测得CO2的浓度为0.1mol/L,根据反应②计算该反应的平衡常数.(写出计算过程)
考点:反应热和焓变,化学平衡的计算
专题:化学反应中的能量变化,化学平衡专题
分析:(1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
(2)结合热化学方程式和盖斯定律计算得到;
(3)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到平衡常数.
(2)结合热化学方程式和盖斯定律计算得到;
(3)依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到平衡常数.
解答:
解:(1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,结合反应热化学方程式①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol,可知碳的燃烧热为393.5kJ/mol;
故答案为:393.5kJ/mol;
(2)①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO2(g)+C(s)═2CO(g)△H=+172.46kJ/mol
依据盖斯定律(①-②)×
得到CO(g)+
O2(g)=CO2(g)△H=-282.98KJ/mol;
故答案为:CO(g)+
O2(g)=CO2(g)△H=-282.98KJ/mol;
(3)在2L密闭容器中,充入1mol CO2气体和1mol 固体C混合反应,当反应达到平衡时,测得CO2的浓度为0.1mol/L,注意碳为固体,
CO2(g)+C(s)═2CO(g)
起始量(mol/L) 0.5 0
变化量(mol/L) 0.4 0.8
平衡量(mol/L) 0.1 0.8
平衡常数K
=6.4
答:CO2(g)+C(s)═2CO(g)
起始量(mol/L) 0.5 0
变化量(mol/L) 0.4 0.8
平衡量(mol/L) 0.1 0.8
平衡常数K
=6.4.
故答案为:393.5kJ/mol;
(2)①C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
②CO2(g)+C(s)═2CO(g)△H=+172.46kJ/mol
依据盖斯定律(①-②)×
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:CO(g)+
| 1 |
| 2 |
(3)在2L密闭容器中,充入1mol CO2气体和1mol 固体C混合反应,当反应达到平衡时,测得CO2的浓度为0.1mol/L,注意碳为固体,
CO2(g)+C(s)═2CO(g)
起始量(mol/L) 0.5 0
变化量(mol/L) 0.4 0.8
平衡量(mol/L) 0.1 0.8
平衡常数K
| 0.82 |
| 0.1 |
答:CO2(g)+C(s)═2CO(g)
起始量(mol/L) 0.5 0
变化量(mol/L) 0.4 0.8
平衡量(mol/L) 0.1 0.8
平衡常数K
| 0.82 |
| 0.1 |
点评:本题考查热化学方程式和盖斯定律计算应用,化学平衡常数概念的计算,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
能正确表示下列化学反应的离子方程式的是( )
| A、碳酸钙溶于稀盐酸中:CO32-+2H+=H2O+CO2↑ |
| B、澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O |
| C、铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag |
| D、氢氧化钡溶液与盐酸的反应:OH-+H+=H2O |
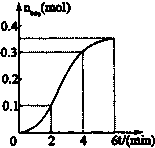 已知CaCO3与稀盐酸的反应为放热反应,取一定量的CaCO3与稀盐酸进行实验,生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
已知CaCO3与稀盐酸的反应为放热反应,取一定量的CaCO3与稀盐酸进行实验,生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A、反应开始后2~4分钟内平均反应速率最大 |
| B、反应刚开始时反应速率较小,然后逐渐增大 |
| C、反应前阶段速率逐渐增大,是因为反应放热,使反应速率加快 |
| D、生成物CaCl2、CO2和H2O的总能量比反应物CaCO3和盐酸的总能量高 |
四个试管中都装有5mL 0.1mol?L-1 Na2S2O3溶液,分别在不同温度下加入下列硫酸,最先出现浑浊的是( )
| A、20℃,5mL,0.1 mol?L-1的硫酸 |
| B、20℃,4 mL,0.2 mol?L-1的硫酸 |
| C、30℃,3 mL,0.2 mol?L-1的硫酸 |
| D、30℃,4 mL,0.1 mol?L-1的硫酸 |
在一定温度下的定容密闭容器中,下列情况能表明可逆反应:H2(g)+I2(g)?2HI(g)已达平衡的是( )
| A、H2的生成速率与I2的生成速率相等 |
| B、反应容器内的压强不随时间的变化而变化 |
| C、H2、I2、HI的浓度相等 |
| D、若单位时间内生成n mol H2的同时生成2n mol HI |

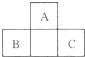 如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则:
如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则: