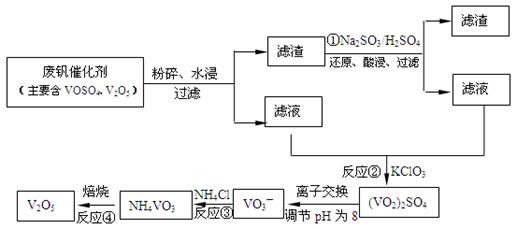
��Ŀ����
�ö������ȣ�ClO2���������ƣ�Na2FeO4Ħ������Ϊ166g/mol�������;�ˮ�������ͳ�ľ�ˮ��Cl2�Ե�ˮ���������dz�������ˮ�����¼�����ClO2��Na2FeO4��ˮ���������зֱ𱻻�ԭΪCl����Fe3����
��1������Ե�λ���������������õ��ĵ���������ʾ����Ч�ʣ���ô��ClO2��Na2FeO4��Cl2��������ɱ����������Ч���ɴ�С��˳����________��__________��__________��
��2��Na2FeO4����ˮ��ų�һ����ɫ��ζ���壬��ɱ������������ˮ�е��������ʵ�ԭ���������ӷ���ʽ��ʾΪ_______________��
��3����ҵ��CH3OH��NaClO3Ϊԭ����������������ȡClO2��ͬʱ����CO2���壬��֪�÷�Ӧ��Ϊ�������У���һ��Ϊ2ClO3-��2Cl����4H����2ClO2����Cl2����2H2O��
��д���ڶ�����Ӧ�����ӷ���ʽ______________��
�ڹ�ҵ����ʱ���ڷ�Ӧ���м�����Cl������������________________��
�������лᷢ������ӦClO3-��Cl����H����Cl2����H2O��δ��ƽ��������÷�Ӧ��Ļ��������Cl2���������Ϊ3��73������ʼͶ��ʱCH3OH��NaClO3�����ʵ���֮��Ϊ____________��
��4����֪����������һ�ֻ���ɫ�д̼�����ζ�����壬���۵�Ϊ��59�棬�е�Ϊ11.0�棬������ˮ��ClO2Ҳ���Կ����������ᣨHClO2�������ᣨHClO3���Ļ����������ҵ�����Գ�ʪ��KClO3�Ͳ�����60��ʱ��Ӧ�Ƶá�ijѧ������ͼ��ʾ��װ��ģ�ҵ��ȡ���ռ�ClO2������AΪClO2�ķ���װ�ã�BΪClO2������װ�ã�CΪβ������װ�á����ʣ�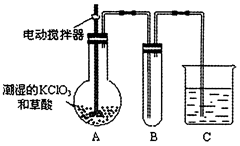
��A���ֻ�Ӧ�����¶ȿ��ƣ���ˮԡ���ȣ�װ�ã�B���ֻ�Ӧ����ʲôװ��___________��
��C��Ӧװ���Լ�Ϊ____________��C�з�����Ӧ�Ļ�ѧ����ʽΪ��________________��
��1��ClO2; Cl2 Na2FeO4 ��2�� 4FeO42-+10 H2O=4Fe��OH��3+8OH-+3O2����3�� ��CH3OH+3Cl2+H2O=6Cl-+ CO2+6H+.�ڴ�����1:6.1��4���٣���ˮ��������NaOH��Һ 2ClO2+2NaOH=NaClO2+NaClO3+H2O
���������������1�� ClO2��Na2FeO4��Cl2��������ɱ����������Ч�ʷֱ���ClO2: 67.5g��5mol=" 13.5g/mol;" Na2FeO4: 166g��3mol=55.33g/mol;Cl2:71g/ 2mol=35.5g/mol.������������ɱ����������Ч���ɴ�С��˳����ClO2> Cl2>Na2FeO4. ��2�� ��������ɵ�Na2FeO4��H2O����ΪO2������ɱ������������������ԭΪFe3+��Fe3+ˮ�����Fe��OH��3��������ˮ�е��������ʡ��Ӷ�������ˮ���÷�Ӧ�����ӷ���ʽΪ��4FeO42-+10 H2O=4Fe��OH��3+8OH-+3O2������3���ٵڶ�����Ӧ�����ӷ���ʽΪ��CH3OH+3Cl2+H2O=6Cl-+ CO2+6H+�����ɢ��е�������Ӧ����ʽ���Կ�����ת����ͬ�ĵ��ӣ�Cl-���������������ȡ�֮�����ڹ�ҵ����ʱҪ�ڷ�Ӧ���м�����Cl��������ΪCl-�����������á��۽���һ����ڶ����ķ���ʽ���ӿɵ��ܷ���ʽ��6ClO3-��CH3OH��6H��=CO2��+6ClO2����5H2O��������ӦClO3-��Cl����H����Cl2����H2O��ƽ�ɵã�ClO3-��5Cl����6H��=3Cl2����3H2O����÷�Ӧ��Ļ��������Cl2���������Ϊ3��73����������������ʵ���Ϊ73mol����Cl2Ϊ3mol��CO2��ClO2�����ʵ���Ϊ70mol������3mol��Cl2����NaClO3�����ʵ���1mol�����ݷ���ʽ6ClO3-��CH3OH��6H��=CO2��+6ClO2����5H2O��֪����CO2��ClO2�����ʵ���Ϊ70mol����CH3OH�����ʵ���Ϊ10mol������ NaClO3�����ʵ���Ϊ60mol�����Թ�����CH3OH�����ʵ���Ϊ10mol������ NaClO3�����ʵ���Ϊ60mol+3mol=61mol�������ʼͶ��ʱCH3OH��NaClO3�����ʵ���֮��Ϊ10:61=1:6.1.��4�� ����ΪClO2�ķе�ͣ����ӷ�������B���ֻ�Ӧ�����װ��������װ�á������ñ�ˮ���н��¡���CΪβ������װ�ã�����ClO2��������Ӧ������ͨ����NaOH��Һ�����ա���Ӧ�ķ���ʽΪ��2ClO2+2NaOH=NaClO2+NaClO3+H2O��
���㣺��������ˮ�IJ�ͬ������������Ч�ʵıȽϡ�ClO2���Ʒ������ʼ��漰�Ļ�ѧ��Ӧԭ������Ҫ����������ԭ��Ӧ�Ļ�ѧ����ʽ�����ӷ���ʽ����ƽ����д��ʵ��װ�õ�ѡ��Ӧ�ú��йؼ����֪ʶ��

 ��Ч���ܿ�ʱ��ҵϵ�д�
��Ч���ܿ�ʱ��ҵϵ�д�������������ԭ��ӦҲ�����ȷ�Ӧ����( )
| A�����ȵ�̿�������̼��Ӧ | B������ϡ����ķ�Ӧ |
| C��������������ķ�ĩ���Ȼ�茶����� | D��������Ʒ����ķ�Ӧ |
������һ��Ũ�ȵ�����ʱ��������Ӧ�����ӷ���ʽΪ��
aFe+bNO3-+cH+�TdFe2++fFe3++gNO��+hNO2��+kH20�������й��ƶ��У�����ȷ���ǣ�������
| A��2d+3f=3g+h |
| B��c+b=2d+3f |
| C��HNO3��������ǿ��Fe3+ |
| D����Ӧ��ÿ����5��6gFe��ת��0��2mol��0��3mole- |
��֪����������Һ�пɷ��������������ӷ�Ӧ��Ge4����Fe2��===Fe3����Ge3���� Sn2����2Fe3��===2Fe2����Sn4�����ɴ˿���ȷ��Fe2����Ge3����Sn2���������ӵĻ�ԭ����ǿ������˳����
| A��Sn2����Fe2����Ge3�� | B��Sn2����Ge3����Fe2�� |
| C��Ge3����Fe2����Sn2�� | D��Fe2����Sn2����Ge3�� |
ij��Ӧ�ķ�Ӧ�����������У�K2Cr2O7��KCl��CrCl3��Cl2��HCl��H2O����֪��Ӧ�����з������±仯��K2Cr2O7��CrCl3��������˵������ȷ����
| A���ɴ˷�Ӧ��֪������K2Cr2O7��Cl2 |
| B���������ͻ�ԭ�������ʵ���֮��Ϊ1:6 |
| C����ת��0.2mol����ʱ�����ɵĻ�ԭ��������ʵ���Ϊ0.1mol |
| D������������ԭ��Ӧ����Ԫ����μӷ�Ӧ����Ԫ�صı�Ϊ3:7 |
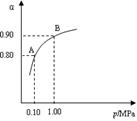
 2SO3(g)����H��0��550 ��ʱ��SO2ת��ΪSO3��ƽ��ת���ʣ���������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ��ʾ��
2SO3(g)����H��0��550 ��ʱ��SO2ת��ΪSO3��ƽ��ת���ʣ���������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ��ʾ��