题目内容
在炼铜的过程中发生:Cu2S + 2Cu2O =" 6Cu" + SO2↑,则下列叙述正确的是
| A.该反应从电子转移角度看,与SO2 + 2H2S =" 3S" + 2H2O是同一反应类型 |
| B.该反应从电子转移角度看,每生成6 mol铜,转移电子12 mol |
| C.该反应中,氧元素氧化了硫元素 |
| D.该反应中,Cu2S既是还原剂又是氧化剂 |
D
解析试题分析:分析该反应的元素化合价的变化,Cu元素化合价降低,S元素化合价升高,O元素化合价不变。每生成6mol铜转移9mol电子,Cu2O在此反应中作氧化剂,Cu2S既作氧化剂,又作还原剂。综合比较,只有D选项正确。
考点:考查元素及化合物、化学反应的类型、电子转移、氧化还原反应等相关知识。

练习册系列答案
相关题目
已知常温下在溶液中可发生如下两个离子反应:Ge4++Fe2+===Fe3++Ge3+, Sn2++2Fe3+===2Fe2++Sn4+;由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是
| A.Sn2+、Fe2+、Ge3+ | B.Sn2+、Ge3+、Fe2+ |
| C.Ge3+、Fe2+、Sn2+ | D.Fe2+、Sn2+、Ge3+ |
根据下列事实,可知X、Y、Z、W还原性由强到弱的顺序是
① X+Y2+=X2++Y ② Z+2H2O=Z(OH)2+H2↑ ③ Z2+比X2+的氧化性弱
④Y元素最高价氧化物对应水化物的碱性比W元素最高价氧化物对应水化物的碱性强
| A.X>Z>Y>W | B.Z>W>X>Y |
| C.Z>X>Y>W | D.Z>Y>X>W |
对于反应3Cl2+6NaOH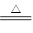 5NaCl+NaClO3+3H2O,以下叙述正确的是
5NaCl+NaClO3+3H2O,以下叙述正确的是
| A.Cl2是氧化剂,NaOH是还原剂 |
| B.当有6.72L Cl2反应时,转移电子物质的量为0.5mol |
| C.氧化剂得电子总数与还原剂失电子总数之比为1∶1 |
| D.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1 |
下列反应既是氧化还原反应,又是吸热反应的是
| A.锌粒与稀H2SO4反应 | B.Ba(OH)2·8H2O与NH4Cl反应 |
| C.灼热的碳与CO2反应 | D.葡萄糖在人体内氧化 |
已知浓H2SO4和Fe3+都可以将Cu氧化(Fe3+与Cu的反应为:2Fe3+ + Cu = 2Fe2+ + Cu2+),浓H2SO4还可以将Br-氧化成Br2,Fe与Br2反应生成FeBr3,则有关物质氧化性强弱的顺序为
| A.H2SO4(浓) > Cu2+ > Fe3+ > Br2 | B.H2SO4(浓) > Br2 > Fe3+ > Cu2+ |
| C.Br2 > H2SO4(浓) > Cu2+ > Fe3+ | D.Cu2+ > Fe3+ > Br2 > H2SO4(浓) |
下列事实不能说明元素的金属性或非金属性相对强弱的是
| 序号 | 事实 | 推论 |
| A | 与冷水反应,Na比Mg剧烈 | 金属性:Na > Mg |
| B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca > Mg |
| C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S > C |
| D | t℃时,Br2 + H2 2HBr K = 5.6×107 2HBr K = 5.6×107I2 + H2  2HCl K = 43 2HCl K = 43 | 非金属性:Br > I |
某反应的反应物与生成物有:K2Cr2O7、KCl、CrCl3、Cl2、HCl、H2O,已知反应过程中发生如下变化:K2Cr2O7→CrCl3,则下列说法不正确的是
| A.由此反应可知氧化性K2Cr2O7>Cl2 |
| B.氧化剂和还原剂的物质的量之比为1:6 |
| C.当转移0.2mol电子时,生成的还原产物的物质的量为0.1mol |
| D.发生氧化还原反应的氯元素与参加反应的氯元素的比为3:7 |
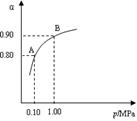
 2SO3(g);△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。
2SO3(g);△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。