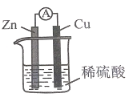
题目内容
【题目】元素化合物在生产生活中有很多应用,写出与下列应用相关的化学方程式 。
(1)漂白粉生效原理______________________________________________
(2)粗硅的制取___________________________________________________
(3)过氧化氢氧化碘离子___________________________________________
(4)实验室制取氨气_______________________________________________
(5)过量二氧化硫与澄清石灰水反应_____________________________________________
(6)氯碱工业生产氯气_____________________________________________
【答案】Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO SiO+2C![]() Si+2CO↑ H2O2 + 2I- + 2H+ = 2H2O + I2
Si+2CO↑ H2O2 + 2I- + 2H+ = 2H2O + I2 ![]() 2SO2+Ca(OH)2=Ca(HSO3)2 2Cl-+2H2O
2SO2+Ca(OH)2=Ca(HSO3)2 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
【解析】
(1)漂白粉生效原理是次氯酸盐吸收空气中的水和二氧化碳变为次氯酸,方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
(2)工业通过高温C还原二氧化硅制取粗硅,方程式为SiO+2C![]() Si+2CO↑
Si+2CO↑
(3)过氧化氢氧化碘离子,过氧化氢作氧化剂,还原产物为水,碘离子为还原剂,氧化产物为碘单质,方程式为H2O2 + 2I- + 2H+ = 2H2O + I2
(4)实验室通过加热氯化铵和氢氧化钙的混合固体来制备氨气,方程式为![]()
(5)可类比过量二氧化碳与澄清石灰水的反应来写出过量二氧化硫与澄清石灰水反应,方程式为2SO2+Ca(OH)2=Ca(HSO3)2
(6)氯碱工业为电解饱和食盐水制取氯气,方程式为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑

 阅读快车系列答案
阅读快车系列答案【题目】t℃时,在体积不变的容器中发生反应X(g)+3Y(g) ![]() aZ(g) △H<0,各组分浓度如下表
aZ(g) △H<0,各组分浓度如下表
物质 | X | Y | Z |
初始浓度/ mol·L-1 | 0.1 | 0.3 | 0 |
2min末浓度/mol·L-1 | 0.08 | 0.04 | |
平衡浓度/mol·L-1 | 0.1 |
(1)0~2min的平均速率ν(Y) =___________________
(2)达平衡时X的转化率为___________________
(3)a =_______________
(4)平衡时Y的浓度为________________
(5)下列能表示该反应一定达到平衡状态的______________
①单位时间内生成n mol X的同时生成n mol Z
②c(X):c(Y):c(Z)的比值不再变化
③容器中的气体的质量不再变化
④容器中混合气体的平均相对分子质量不再变化