题目内容
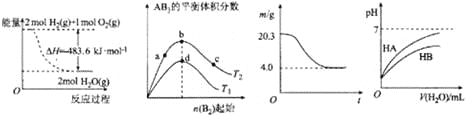
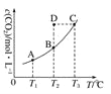
【题目】在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)![]() CO2(g)+H2(g),CO2的平衡浓度c(CO2)与温度T的关系如图所示。
CO2(g)+H2(g),CO2的平衡浓度c(CO2)与温度T的关系如图所示。
下列说法错误的是
A. 反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的 ΔH﹥0
CO2(g)+H2(g)的 ΔH﹥0
B. 在T2时,若反应处于状态D,则一定有ν(正)﹥ν(逆)
C. 平衡状态A与C相比,平衡状态A的c(CO)大
D. 若T1、T2时的平衡常数分别为K1、K2,则K1﹤K2
【答案】B
【解析】
A.由图可知,温度越高平衡时c(CO2)越大,说明升高温度平衡向正反应方向移动,升高温度平衡向吸热反应进行,故正反应是吸热反应,即△H>0,故A正确;
B.T2时若反应处于状态D,c(CO2)高于平衡浓度,故反应一定向逆反应方向进行,则一定有υ(正)<υ(逆),故B错误;
C.平衡状态A与C相比,C点温度高,已知△H>0,升高温度平衡向正反应方向移动,CO浓度减小,所以A点CO浓度大,故C正确;
D.该反应正反应是吸热反应,升高温度平衡向正反应方向移动,化学平衡常数增大,故K1<K2,故D正确;
故答案选B。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案【题目】(1)反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,试回答:(填“加快”、“不变”或“减慢”)。
Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,试回答:(填“加快”、“不变”或“减慢”)。
①保持体积不变充入Ne,其反应速率___。
②保持压强不变充入Ne,其反应速率____。
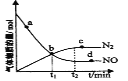
(2)在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中v(正)与v(逆)相等的点为__(选填字母)。
5N2(g)+6H2O(g)。某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中v(正)与v(逆)相等的点为__(选填字母)。
(3)一定条件下,在2L密闭容器内,发生反应2NO2(g)![]() N2O4(g),n(NO2)随时间变化如下表:
N2O4(g),n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
①用NO2表示0~2s内该反应的平均速率为___。
②在第5s时,NO2的转化率为__。