题目内容
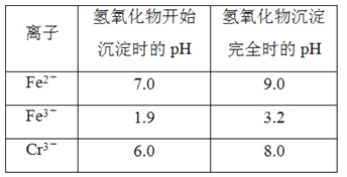
【题目】t℃时,在体积不变的容器中发生反应X(g)+3Y(g) ![]() aZ(g) △H<0,各组分浓度如下表
aZ(g) △H<0,各组分浓度如下表
物质 | X | Y | Z |
初始浓度/ mol·L-1 | 0.1 | 0.3 | 0 |
2min末浓度/mol·L-1 | 0.08 | 0.04 | |
平衡浓度/mol·L-1 | 0.1 |
(1)0~2min的平均速率ν(Y) =___________________
(2)达平衡时X的转化率为___________________
(3)a =_______________
(4)平衡时Y的浓度为________________
(5)下列能表示该反应一定达到平衡状态的______________
①单位时间内生成n mol X的同时生成n mol Z
②c(X):c(Y):c(Z)的比值不再变化
③容器中的气体的质量不再变化
④容器中混合气体的平均相对分子质量不再变化
【答案】0.03 mol·L-1·min-1 50% 2 0.15mol·L-1 ②④
【解析】
X(g) + 3Y(g) ![]() aZ(g)
aZ(g)
初始浓度/ mol·L-1 0.1 0.3 0
变化浓度/ mol·L-1 0.02 0.06 0.04
2min末浓度/mol·L-1 0.08 0.24 0.04
根据反应速率之比等于相应的化学计量数之比,可知a=2;
X(g) + 3Y(g) ![]() 2Z(g)
2Z(g)
初始浓度/ mol·L-1 0.1 0.3 0
变化浓度/ mol·L-1 0.05 0.15 0.1
平衡浓度/mol·L-1 0.05 0.15 0.1
(1) 由分析可知,0~2min的平均速率ν(Y)=![]() =0.03 mol·L-1·min-1;
=0.03 mol·L-1·min-1;
(2) 由上述计算可知,达平衡时X的转化率为![]() ×100%=50%;
×100%=50%;
(3) 由分析可知,a=2;
(4) 由上述计算可知,平衡时Y的浓度为0.15mol·L-1;
(5) 反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断。
①单位时间内生成n mol X的同时生成n mol Z,正逆反应速率不相等,故①错误;
②未达到平衡时c(X):c(Y):c(Z)的比值会一直变化,当c(X):c(Y):c(Z)的比值不再变化时,可判断反应达到了平衡状态,故②正确;
③该反应的反应物和生成物均为气体,由质量守恒定律可知,容器中的气体质量一直不会变化,故容器中的气体的质量不再变化,不能判断反应达到了平衡状态,故③错误;
④M=![]() ,该反应是前后气体数目不相等的反应,未达到平衡时容器中混合气体的平均相对分子质量一直在改变,所以当容器中混合气体的平均相对分子质量不再变化时,可判断反应达到了平衡状态,故④正确;
,该反应是前后气体数目不相等的反应,未达到平衡时容器中混合气体的平均相对分子质量一直在改变,所以当容器中混合气体的平均相对分子质量不再变化时,可判断反应达到了平衡状态,故④正确;
答案选②④。

【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和碘单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
A. A B. B C. C D. D