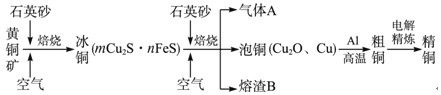
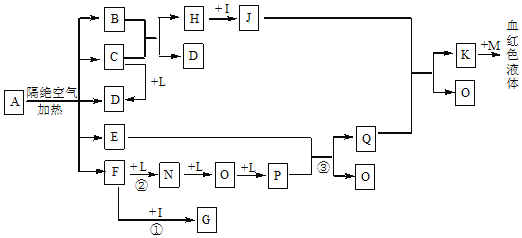
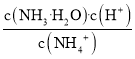题目内容
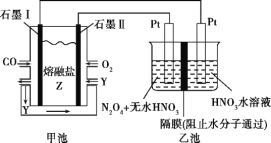
【题目】某同学组装了如图所示的电化学装置,则下列说法正确的是( )

A.图中甲池为原电池装置,Cu电极发生还原反应
B.实验过程中,甲池左侧烧杯中NO3-的浓度不变
C.若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是AgNO3溶液
D.若用铜制U形物代替“盐桥”,工作一段时间后取出U型物称量,质量不变
【答案】CD
【解析】
甲池为原电池装置,活泼的铜失电子作负极,电流方向从正极流向负极,负极上失电子发生氧化反应,正极上得电子发生还原反应,铜放电生成铜离子,盐桥中的阴离子硝酸根离子向左边移动,如果用铜制U形物代替“盐桥”,甲池中的右边一个池为原电池装置,据此分析解答。
A. 图中甲池为原电池装置,Cu电极为负极发生氧化反应,故A错误;
B. 实验过程中,铜放电生成铜离子,盐桥中的阴离子硝酸根离子向左边移动,所以左侧烧杯中NO3的浓度变大,故B错误;
C. 若甲池中Ag电极质量增加5.4g时,即生成银5.4g,物质的量为![]() ,所以整个电路转移0.05mol的电子,如果乙池中是足量硝酸银应生成5.4g的银,只生成1.6g,这说明硝酸银不足,可能含有硝酸银,故C正确;
,所以整个电路转移0.05mol的电子,如果乙池中是足量硝酸银应生成5.4g的银,只生成1.6g,这说明硝酸银不足,可能含有硝酸银,故C正确;
D. 用铜制U形物代替“盐桥”,右边铜的质量减少,而左边铜的质量增加,而整个电路转移电子数相等,所以减少的质量与增加的质量相等,U型管的质量不变,故D正确;
故选CD。

练习册系列答案
相关题目