题目内容
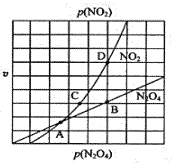
【题目】现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1) m+n_________p(填“>”“=”“<”)。
(2)若加压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入A(体积不变),则B的转化率_________。
(4)若降低温度,则平衡时B、C的浓度之比![]() 将_________。
将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量___________。
(6)若B是有色物质,A、C均无色,维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
【答案】> 减小 增大 增大 不变 变浅
【解析】
(1)当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,则方程式中反应物的气体的计量数之和大于生成物气体的化学计量数之和;
(2)反应物的气体的计量数之和大于生成物气体的化学计量数之和,加压平衡正向移动;
(3)加热A平衡正向移动,B的转化率增大;
(4)达到平衡后,当升高温度时,B的转化率变大,说明温度升高平衡向正反应方向移动,则正反应吸热,降温平衡逆向移动;
(5)催化剂不影响平衡移动;
(6)维持容器内压强不变,充入氖气时,容器的体积增大,所有反应物和生成物的浓度都会减小。
(1)达到平衡后,当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,则方程式中反应物的气体的计量数之和大于生成物气体的化学计量数之和,故m+n>p。
(2)增大压强时,平衡向着方程式中气体的计量数之和增大的反应方向移动,即向着正反应方向移动,则A的质量分数减小。
(3)若加入A(体积不变),平衡向着正反应方向移动,则B的转化率增大。
(4)正反应放热,若降低温度,平衡逆向移动,C的物质的量减少,B的物质的量增大,所以二者的浓度比值将增大。
(5)催化剂对化学平衡移动没有影响,所以若加入催化剂,该反应平衡时气体混合物的总物质的量不变。
(6)若B是有色物质,A、C均为无色物质,维持容器内压强不变,充入氖气时,反应体系气体的压强减小,B物质浓度减小,所以体系颜色变浅。

【题目】甲、乙同学用0.10mol/L H2C2O4草酸溶液、0.01mol/L KMnO4溶液、0.01mol/L H2SO4溶液、一定量的蒸馏水等试剂,进行探究实验,通过测定溶液褪色所需时间来探究浓度、温度对反应速率的影响。
(1)已知酸性KMnO4与H2C2O4反应后Mn元素以Mn2+形式存在溶液中,C元素转化为CO2气体逸出,请写出该反应的化学方程式____________。
(2)为探究反应物浓度、温度对化学反应速率的影响。甲同学设计的实验方案如下表:
实验序号 | 温度/℃ | 体积V/ mL | |||
H2C2O4溶液 | 水 | KMnO4溶液 | H2SO4溶液 | ||
1 | 25 | 10.0 | 0.0 | 4.0 | 2.0 |
2 | 25 | 8.0 | a | 4.0 | 2.0 |
3 | 50 | b | 0.0 | 4.0 | 2.0 |
①若以实验1为对照组,为了达到实验探究目的则a=____________,b=____________。
②若实验1测得溶液褪色所需时间为5s,则用高锰酸钾表示的反应速率为______________________。
(3)乙同学部分实验设计方案如下表:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
mol/L | mL | mol/L | mL | ||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 |
② | 0.10 | 2.0 | 0.02 | 4.0 | 25 |
…… | |||||
该同学想通过实验①和②探究反应物浓度对化学反应速率的影响,请你对该方案的合理性进行评价,并说明理由__________________________。