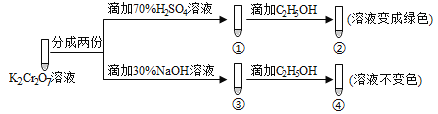
题目内容
【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+
2NH3(g)+![]() O2(g) △H=a kJ mol-1 。
O2(g) △H=a kJ mol-1 。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2 mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H=-92.4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
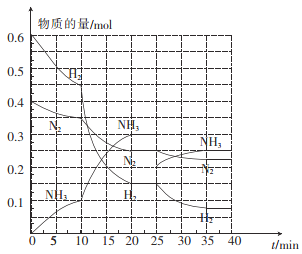
① 0~10 min内,以NH3表示的平均反应速率为_________。
② 在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 在反应进行至25 min时,曲线发生变化的原因是____________,达到第二次平衡时,新平衡的平衡常数K2______K1(填“>”“<”或“ = ”)
【答案】(1)> ;>
(2)①0.005 mol L-1 min-1
②BC
③移走 0.1 molNH3 ; =
【解析】
试题分析:(1)升高温度NH3的物质的量最多,所以N2(g)+3H2O(l) ![]() 2NH3(g)+
2NH3(g)+![]() O2反应吸热,a>0;反应后气体物质的量增多,△S>0;(2)① 0~10 min内,以NH3表示的平均反应速率为
O2反应吸热,a>0;反应后气体物质的量增多,△S>0;(2)① 0~10 min内,以NH3表示的平均反应速率为![]()
![]() 0.005 mol L-1 min-1;② 在10~20 min内,NH3浓度逐渐增大,变化的原因可能是A.加入催化剂,平衡不移动,NH3物质的量不变,A错误; B.缩小容器体积,平衡正向移动,氨气的物质的量增大,B正确 ; C.降低温度,平衡正向移动,NH3物质的量增大,C正确; D.增加NH3的物质的量,平衡逆向移动,氮气、氢气增多,D错误;③ 在反应进行至25 min时,氨气的物质的量突然由0.3mol变为0.2mol,曲线发生变化的原因是移走 0.1 molNH3,平衡常数只与温度有关,温度不变平衡常数不变,达到第二次平衡时,新平衡的平衡常数K2=K1。
0.005 mol L-1 min-1;② 在10~20 min内,NH3浓度逐渐增大,变化的原因可能是A.加入催化剂,平衡不移动,NH3物质的量不变,A错误; B.缩小容器体积,平衡正向移动,氨气的物质的量增大,B正确 ; C.降低温度,平衡正向移动,NH3物质的量增大,C正确; D.增加NH3的物质的量,平衡逆向移动,氮气、氢气增多,D错误;③ 在反应进行至25 min时,氨气的物质的量突然由0.3mol变为0.2mol,曲线发生变化的原因是移走 0.1 molNH3,平衡常数只与温度有关,温度不变平衡常数不变,达到第二次平衡时,新平衡的平衡常数K2=K1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】
(1)配制100 mL 0.10 mol·L-1NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→___ ___(冷却后)→洗涤(并将洗涤液移入容量瓶)→___ ___→___ ___→将配制好的溶液倒入试剂瓶中,贴上标签。
②称量________g氢氧化钠固体所需仪器有:托盘天平(带砝码、镊子)、________、________。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用已配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验 | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是___________________________________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为_____________(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________(填字母序号)。
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
【题目】汽车尾气中含有CO、NO等有害气体。

(1)汽车尾气中NO生成过程的能量变化示意图如图。该条件下,1molN2和1molO2完全反应生成NO会_______________(填“吸收”或“放出”)___________kJ能量。
(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:
①NiO电极上发生的是___________反应(填“氧化”或“还原”)。
②外电路中,电子流动方向是从_________电极流向_______电极(填“NiO”或“Pt”).
③Pt电极上的电极反应式为_______________________________。
(3)一种新型催化剂能使NO和CO发生反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度 | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10﹣3 | 5.80×10﹣3 | 82 |
Ⅱ | 280 | 1.2×10﹣3 | b | 124 |
Ⅲ | 350 | a | 5.80×10﹣3 | 82 |
①请表中数据补充完整:a___________;b____________。
②能验证温度对化学反应速率规律的是实验____________________(填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线________________(填“甲”或“乙”)。