题目内容
【题目】科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。请回答下列问题:
(1)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0kJ/mol
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol
由上述方程式可知,CH3OH(g)的燃烧热__________(填“大于”、“等于”或小于”)192.9kJ/mol。已知水的汽化热为44 kJ/mol,则表示氢气燃烧热的热化学方程式为__________________________。
(2)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃)该反应为_________反应(填“放热”或“吸热”);在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为____________________。

【答案】(1)大于;H2(g)+1/2O2=H2O(l) △H=-124.4kJ/mol
(2)放热 (2-a)/2
【解析】
试题分析:(1)燃烧热是指25 ℃,101 kPa时,1mol可燃物完全燃烧生成稳定的氧化物时的反应热,水的状态应为液态,气态水转化为液态水放热,由②可知CH3OH(g)的燃烧热大于192.9kJ/mol;已知水的汽化热为44 kJ/mol,根据盖斯定律分析表示氢气燃烧热的热化学方程式为H2(g)+1/2O2=H2O(l) △H=-124.4kJ/mol。
(2)根据题给图像分析可知,T2的反应速率大于T1,由温度升高反应速率增大可知T2>T1,因温度升高,平衡时CH3OH的物质的量减少,则升高温度平衡逆向移动,故正反应为放热反应;利用化学平衡的三段模式法计算:
CO2 (g)+3H2(g)![]() CH3OH(g) +H2O(g)
CH3OH(g) +H2O(g)
起始(mol) 1 3 0 0
变化(mol) a 3a a a
平衡(mol) 1-a 3-3a a a
根据压强之比等于物质的量之比,则容器内的压强与起始压强之比为:(4-2a)/4= (2-a)/2。

【题目】有一种由NaC1O2、NaC1O3和NaClO4组成的混合物,经测定氯元素的质量分数为35.5%,则此混合物中氧元素的质量分数为
A. 25.9% B. 23% C. 41.5% D. 无法计算
【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+
2NH3(g)+![]() O2(g) △H=a kJ mol-1 。
O2(g) △H=a kJ mol-1 。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2 mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H=-92.4 kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
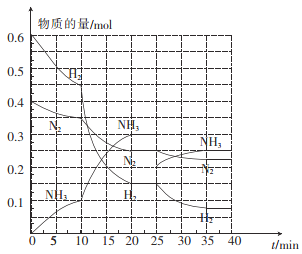
① 0~10 min内,以NH3表示的平均反应速率为_________。
② 在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 在反应进行至25 min时,曲线发生变化的原因是____________,达到第二次平衡时,新平衡的平衡常数K2______K1(填“>”“<”或“ = ”)
