题目内容
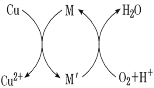
【题目】在海洋碳循环中,通过如图所示的途经固定碳。下列说法错误的是( )
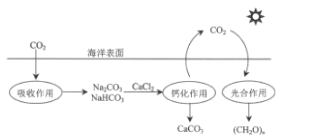
A.该循环过程中未涉及氧化还原反应
B.光合作用能将太阳能转化为化学能
C.钙化作用涉及的离子方程式之一为Ca2++2HCO3-═CaCO3↓+CO2↑+H2O
D.吸收作用中产生HCO3-的途径为CO2+H2OH2CO3,H2CO3HCO3-+H+
【答案】A
【解析】
A. 根据图示,光合作用中CO2→(CH2O)x,C的化合价由+4价→0价,化合价发生改变,即光合作用涉及氧化还原反应,故A说法错误;
B. 光合作用是将太阳能转化成为化学能,故B说法正确;
C. HCO3-发生电离HCO3-![]() H++CO32-,Ca2+与CO32-结合生成沉淀CaCO3,促使平衡向正反应方向进行,即钙化作用涉及的离子方程式之一是Ca2++2HCO3-=CaCO3↓+CO2↑+H2O,故C说法正确;
H++CO32-,Ca2+与CO32-结合生成沉淀CaCO3,促使平衡向正反应方向进行,即钙化作用涉及的离子方程式之一是Ca2++2HCO3-=CaCO3↓+CO2↑+H2O,故C说法正确;
D. 吸收作用中CO2先与水反应CO2+H2O![]() H2CO3,H2CO3属于二元弱酸,以第一步电离为主,发生H2CO3
H2CO3,H2CO3属于二元弱酸,以第一步电离为主,发生H2CO3![]() H++HCO3-,故D说法正确;
H++HCO3-,故D说法正确;
答案:A。

 习题精选系列答案
习题精选系列答案【题目】一定温度下,在 3个体积均为 20L的密闭真空容器中发生如下反应(假设容器体积不变,固体试样体积忽略不计):NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据如表所示:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据如表所示:
容器 | 温度/℃ | 起始物质的量(n/mol) | 平衡物质的量(n/mol) | ||
n(NH2COONH4) | n(NH3) | n(CO2) | n(CO2) | ||
I | 15 | 1.00 | 0 | 0 | 0.016 |
II | 15 | 2.00 | 0 | 0 | a |
III | 35 | 0 | 4.00 | 2.00 | b |
下列说法不正确的是
A.当反应进行到30min时测得容器Ⅰ中混合气体的物质的量为 0.036mol,则30min 内该反应的平均速率 v(NH3)=4×10-5mol·L-1·min-1
B.当密闭容器中的二氧化碳的体积分数不变时,不能说明该反应到达了平衡
C.若该反应的正反应为吸热反应,则 b一定大于0.032
D.达到平衡时反应物的转化率:α(Ⅰ)> α (Ⅱ)