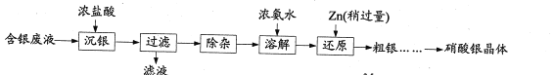
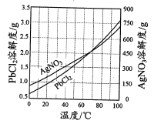
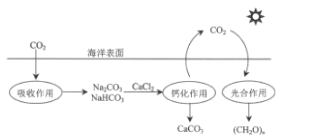
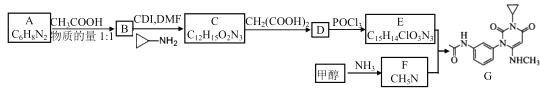
题目内容
【题目】一定温度下,在 3个体积均为 20L的密闭真空容器中发生如下反应(假设容器体积不变,固体试样体积忽略不计):NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据如表所示:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据如表所示:
容器 | 温度/℃ | 起始物质的量(n/mol) | 平衡物质的量(n/mol) | ||
n(NH2COONH4) | n(NH3) | n(CO2) | n(CO2) | ||
I | 15 | 1.00 | 0 | 0 | 0.016 |
II | 15 | 2.00 | 0 | 0 | a |
III | 35 | 0 | 4.00 | 2.00 | b |
下列说法不正确的是
A.当反应进行到30min时测得容器Ⅰ中混合气体的物质的量为 0.036mol,则30min 内该反应的平均速率 v(NH3)=4×10-5mol·L-1·min-1
B.当密闭容器中的二氧化碳的体积分数不变时,不能说明该反应到达了平衡
C.若该反应的正反应为吸热反应,则 b一定大于0.032
D.达到平衡时反应物的转化率:α(Ⅰ)> α (Ⅱ)
【答案】C
【解析】
A. 根据该反应可知,NH2COONH4是固体,此反应生成NH3、CO2的物质的量之比是2:1,NH3占三分之二,而30min时,混合气体的物质的量共为0.036mol,故其中NH3的物质的量为0.024mol,则 30min内该反应的平均速率v(NH3)= =4×10-5mol/(Lmin),A正确;
=4×10-5mol/(Lmin),A正确;
B. 根据该反应可知,NH2COONH4是固体,此反应生成NH3、CO2的物质的量之比是恒定的,即无论平衡与否,二氧化碳的体积分数不变,故当密闭容器中的二氧化碳的体积分数不变时,不能说明该反应到达了平衡,B正确;
C. 容器Ⅱ相当于是将两个容器Ⅰ压缩得到,压缩时化学平衡逆向移动,故a小于0.032mol,若Ⅲ所处的温度和II相同,则Ⅲ和Ⅱ是等效平衡,即若III所处的温度也为15℃,则b=a<0.032mol,但Ⅲ的温度为35℃,升高温度,化学平衡向吸热的正反应方向移动,故平衡时CO2的物质的量增大,但不一定大于0.032mol,C错误;
D. 容器Ⅱ相当于是将两个容器I压缩得到,压缩时气体压强增大,化学平衡逆向移动,故Ⅱ反应达平衡时反应物的转化率低于Ⅰ,即达到平衡时反应物的转化率:α(Ⅰ)> α (Ⅱ),D正确;
故合理选项是C。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案【题目】有U、V、W、X、Y、Z六种前四周期元素,原子序数依次增大,其相关信息如下表:
元素编号 | 相关信息比 |
U | 所处的周期数、族序数分别与其原子序数相等 |
V | 基态时,电子分布在三个能级上,且各能级中电子数相等 |
W | 基态时, 2p 轨道处于半充满状态 |
X | 自然界中含量最多 |
Y | 是第四周期元素中未成对电子数最多的元素 |
请回答下列问题:
(1)W、X、V第一电离能由大到小顺序:________________________(用元素符号表示)
(2)V的最高价氧化物对应含氧酸中,酸根的立体构型为:_________,中心原子的杂化方式为:_______________;
(3)Y的基态原子的价电子排布图为____________________________;
(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有10个电子。两者沸点的关系为乙______丙(填“>”或“<”),原因是__________________________________________;
(5)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中属于____________晶体