题目内容
【题目】镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通讯等领域。回答下列问题:
(1)硒常用作光敏材料,基态硒原子的核外电子排布式为[Ar]_______;与硒同周期的p区元素中第一电离能大于硒的元素有_____种;SeO3的空间构型是_______。
(2)根据元素周期律,原子半径Ga ___As,第一电离能Ga _____As。(填“大于”或“小于”)
(3)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是______,硅与氢结合能形成一系列的二元化合物SiH4、Si2H6等,与氯、溴结合能形成SiCl4 、SiBr4,上述四种物质的沸点由高到低的顺序为__________,丁硅烯(Si4H8)中σ键与π键个数之比为___。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因___。
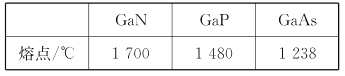
(5)GaN晶体结构如图所示。已知六棱柱底边边长为a cm,阿伏加德罗常数的值为NA。
①晶体中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为_____。
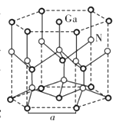
②从GaN晶体中“分割”出的平行六面体如图所示。若该平行六面体的体积为![]() cm3,GaN晶体的密度为____g/cm3(用a、NA表示)。
cm3,GaN晶体的密度为____g/cm3(用a、NA表示)。
【答案】![]() 3 平面三角形 > < 4
3 平面三角形 > < 4 ![]() 11:1 结构相似的前提下,原子晶体的熔沸点与成键原子的半径呈反比,原子半径大小为N<P<As,因此GaN的熔点最高,GaAs的熔点最低 12
11:1 结构相似的前提下,原子晶体的熔沸点与成键原子的半径呈反比,原子半径大小为N<P<As,因此GaN的熔点最高,GaAs的熔点最低 12 ![]()
【解析】
(1)按要求画出硒原子的核外电子排布式即可,同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素;气态![]() 分子中Se原子孤电子对数为0,价层电子对数为3,因此为平面三角形;
分子中Se原子孤电子对数为0,价层电子对数为3,因此为平面三角形;
(2)同周期主族元素的原子半径随原子序数的递增而逐渐减小,据此来分析即可;
(3)二氧化硅中1个硅原子结合4个氧原子,同时每个氧原子结合2个硅原子,对于分子晶体来讲,相对分子质量越大,分子间作用力越强,沸点越高;
(4)原子晶体中各原子之间是靠共价键形成的,在成键数相同的情况下,共价键的强度受成键原子的半径大小影响,半径越小则键能越大,N、P、As同属第VA族,因此三种物质的结构相似,而原子半径大小为N<P<As,因此GaN的熔点最高,GaAs的熔点最低;
(5)从六方晶胞的面心原子分析,上、中、下分别有3、6、3个配位原子,故配位数为12,接下来分析其化学式,位于晶胞顶点的原子为6个晶胞共用,对一个晶胞的贡献为![]() ,位于晶胞面心的原子为2个晶胞共用,对一个晶胞的贡献为
,位于晶胞面心的原子为2个晶胞共用,对一个晶胞的贡献为![]() ,位于晶胞侧棱的原子为3个晶胞共用,对一个晶胞的贡献为
,位于晶胞侧棱的原子为3个晶胞共用,对一个晶胞的贡献为![]() ,位于晶胞底面上的棱棱心的原子为4个晶胞共用,对一个晶胞的贡献为
,位于晶胞底面上的棱棱心的原子为4个晶胞共用,对一个晶胞的贡献为![]() ,位于晶胞体心的原子为1个晶胞共用,对一个晶胞的贡献为1,因此该结构为
,位于晶胞体心的原子为1个晶胞共用,对一个晶胞的贡献为1,因此该结构为![]() ,再根据体积来计算密度即可。
,再根据体积来计算密度即可。
(1)硒是34号元素,其核外电子排布式为![]() ,根据分析可知同周期中只有As、Br、Kr三种元素的第一电离能大于硒,而
,根据分析可知同周期中只有As、Br、Kr三种元素的第一电离能大于硒,而![]() 的结构为平面三角形;
的结构为平面三角形;
(2)同周期主族元素的原子半径随原子序数的递增而逐渐减小,因此镓原子的半径大于砷原子,砷原子处于第VA族,其4p轨道处于半充满的稳定状态,第一电离能较大,因此砷原子的第一电离能大于镓原子;
(3)根据分析,水晶晶体中硅原子的配位数为4,几种分子晶体的熔沸点可以按照相对分子质量的大小来排列,因此沸点有:![]() ,丁硅烯的结构与丁烯类似,分子中有8个
,丁硅烯的结构与丁烯类似,分子中有8个![]() 键,1个
键,1个![]() 双键,2个
双键,2个![]() 键,因此分子中的σ键与π键的数个数之比为11:1;
键,因此分子中的σ键与π键的数个数之比为11:1;
(4)原子晶体中各原子之间是靠共价键形成的,在成键数相同的情况下,共价键的强度受成键原子的半径大小影响,半径越小则键能越大,N、P、As同属第VA族,因此三种物质的结构相似,而原子半径大小为N<P<As,因此GaN的熔点最高,GaAs的熔点最低;
(5)①从六方晶胞的面心原子分析,上、中、下分别有3、6、3个配位原子,故镓原子的配位数为12;
②根据分析得出化学式为![]() ,质量为
,质量为![]() ,该六棱柱的底面为正六边形,边长为a cm,底面的面积为6个边长为a cm的正三角形面积之和,因此该底面的面积为
,该六棱柱的底面为正六边形,边长为a cm,底面的面积为6个边长为a cm的正三角形面积之和,因此该底面的面积为![]() ,高为2倍的正四面体高,因此体积为
,高为2倍的正四面体高,因此体积为![]() ,代入密度公式有
,代入密度公式有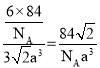 。
。





