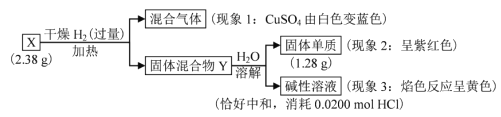
题目内容
【题目】判断正误,正确的画“√”,错误的画“×”
(1)2 g D![]() O中含有的质子数、中子数均为NA_______
O中含有的质子数、中子数均为NA_______
(2)过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA_______
(3)1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA_______
(4)标准状况下,5.6 L NO和5.6 L O2组成的混合气体中所含原子数为NA_______
(5)0.1 mol钠和O2在一定条件下反应完全生成Na2O和Na2O2混合物时,失去电子数为0.1NA _______
(6)14 g乙烯和丙烯混合气体中的氢原子数为2NA_______
(7)在1L 0.1mol·L﹣1碳酸钠溶液中,阴离子总数大于0.1NA _______
(8)高温下,16.8 g Fe与足量水蒸气完全反应失去电子数为0.8 NA _______
(9)标准状况下,氢氧燃料电池正极消耗22.4 L气体时,电路中通过的电子数目为4NA_______
(10)常温常压下 ,1 L液态水中含有的H+数目为10-7NA_______
(11)一定条件下Fe粉与足量的浓硫酸反应,转移电子数为3 NA _______
(12)标准状况下,2.24 L CCl4含有的共价键数为0.4NA_______
(13)标况下,22.4L己烷的分子个数为NA_______
(14)含1 mol H2SO4的浓硫酸与足量Zn反应转移的电子总数为2NA_______
(15)在1L 0.1mol·L﹣1氯化铵溶液中,NH4+ 和NH3·H2O的个数之和为NA _______
【答案】√ √ × √ √ √ √ √ √ √ × × × × ×
【解析】
(1)2gD216O的物质的量为0.1mol,而D216O中含有的质子数、电子数和中子数均为10个,故0.1molD216O中含有的质子、中子和电子数均为1NA个,答案为:√;
(2)过氧化钠与水反应为歧化反应,生成1mol氧气转移2mol电子,所以生成0.1mol氧气转移的电子数为0.2NA,答案为:√;
(3)CH4与Cl2在光照下反应生成多种卤代烃的混合物,1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数少于1.0NA,故答案为:×;
(4)NO和O2为双原子分子,标准状况下,5.6 L NO和5.6 L O2组成的混合气体中所含原子数为(![]() =NA,答案为:√;
=NA,答案为:√;
(5)根据Na的最外层电子数为1,0.1 mol钠和O2在一定条件下反应完全生成Na2O和Na2O2混合物时,失去电子数为0.1NA ,答案为:√;
(6)乙烯和丙烯的最简式为CH2,14 g乙烯和丙烯混合气体中的氢原子数为![]() =2NA,答案为:√;
=2NA,答案为:√;
(7)在1L 0.1mol·L﹣1的碳酸钠溶液中,存在碳酸根离子的水解:CO32-+H2O![]() HCO3-+OH- ①HCO3-+H2O
HCO3-+OH- ①HCO3-+H2O![]() H2CO3+OH- ② (水解过程均为可逆)由①看出 一个CO32-水解后得到2个阴离子,②中1个HCO3-水解后得到1个OH-,阴离子个数不变,如果不考虑离子水解,溶液中CO32-为 0.1NA,由于只有少量的CO32-参加了水解,所以阴离子个数大于0.1NA小于0.2NA,答案为:√;
H2CO3+OH- ② (水解过程均为可逆)由①看出 一个CO32-水解后得到2个阴离子,②中1个HCO3-水解后得到1个OH-,阴离子个数不变,如果不考虑离子水解,溶液中CO32-为 0.1NA,由于只有少量的CO32-参加了水解,所以阴离子个数大于0.1NA小于0.2NA,答案为:√;
(8)高温下,16.8g铁的物质的量为0.3mol,而铁与水蒸气反应后变为+![]() 价,故0.3mol铁失去0.8mol电子即0.8NA个,答案为:√;
价,故0.3mol铁失去0.8mol电子即0.8NA个,答案为:√;
(9)标准状况下22.4L气体的物质的量为1mol,氢氧燃料电池的正极发生还原反应,正极为氧气,所以1mol氧气完全反应得到4mol电子,根据电子守恒,电路中通过的电子数目为4NA,答案为:√;
(10)常温常压下 ,水中氢离子浓度为10-7mol·L-1,1 L液态水中含有的H+数目为10-7NA,答案为:√;
(11)Fe与H2SO4反应量未知,故答案为:×;
(12)标准状况下,CCl4呈液态,故答案为:×;
(13)标况下,己烷呈液态,故答案为:×;
(14)浓硫酸与锌反应生成二氧化硫、稀硫酸与锌反应生成氢气,无法确定反应产物的量,所以无法计算转移的电子数,故答案为:×;
(15)在1L 0.1mol·L﹣1氯化铵溶液中,含有0.1mol溶质氯化铵,由于铵离子部分水解,NH4+ 和NH3·H2O的个数之和为0.1NA,故答案为:×。

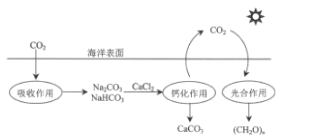
【题目】消除氮氧化物和硫氧化物有多种方法。
(1)用活性炭还原法:某研究小组向某密闭容器中加入足量的活性炭和NO,发生反应:C(s)+2NO(g) ![]() N2(g)+CO2(g) △H=Q kJ·mol-1 在 T1℃下,反应进行到不同时间测得各物质的浓度部分数据如下:
N2(g)+CO2(g) △H=Q kJ·mol-1 在 T1℃下,反应进行到不同时间测得各物质的浓度部分数据如下:
时间(min) 浓度mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.40 | 0.20 | 0.30 | 0.30 | |
N2 | 0 | 0.40 | 0.60 | 0.60 | ||
CO2 | 0 | 0.60 | 0.60 |
①0~10 min 内,N2的平均反应速率 υ(N2)=________,T1℃时,该反应的平衡常数 K=_____。
②30 min 后,若只改变一个条件,反应重新达到平衡时各物质的浓度如上表所示,则改变的条件可能是____________ (填字母)
a. 加入一定量的活性炭 b. 改变反应体系的温度 c. 缩小容器的体积 d. 通入一定量的NO
③若30 min后升高温度至 T2℃,重新达到平衡时,容器中NO、N2、CO2的浓度之比为7∶3∶3,则该反应的△H______0(填“>” 、 “ =” 、或“<” )
(2)NH3催化还原法:原理如图所示

①若烟气中 c(NO2): c(NO)=1∶1,发生如图甲所示的脱氮反应时,反应过程中转移1.5mol电子时放出的热量为 113.8 kJ,则发生该脱氮反应的热化学方程式为_____ 。
②图乙是在一定时间内,使用不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为___;使用Mn作催化剂时,脱氮率b~a段呈现如图变化的可能原因是___。
(3)直接电解吸收也是脱硝的一种方法。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。
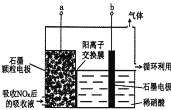
①图中b应连接电源的_________ (填“正极”或“负极”)。
②将石墨电极设置成颗粒状的目是_____________________。
③阳极的电极反应式为___________________。
【题目】有U、V、W、X、Y、Z六种前四周期元素,原子序数依次增大,其相关信息如下表:
元素编号 | 相关信息比 |
U | 所处的周期数、族序数分别与其原子序数相等 |
V | 基态时,电子分布在三个能级上,且各能级中电子数相等 |
W | 基态时, 2p 轨道处于半充满状态 |
X | 自然界中含量最多 |
Y | 是第四周期元素中未成对电子数最多的元素 |
请回答下列问题:
(1)W、X、V第一电离能由大到小顺序:________________________(用元素符号表示)
(2)V的最高价氧化物对应含氧酸中,酸根的立体构型为:_________,中心原子的杂化方式为:_______________;
(3)Y的基态原子的价电子排布图为____________________________;
(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有10个电子。两者沸点的关系为乙______丙(填“>”或“<”),原因是__________________________________________;
(5)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中属于____________晶体