题目内容
15. (1)有下列五种烃:
(1)有下列五种烃:①
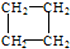 ②
②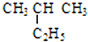 ③乙烷 ④C(CH3)4⑤
③乙烷 ④C(CH3)4⑤ ,其中互为同分异构体的是②④(填序号),②与⑤
,其中互为同分异构体的是②④(填序号),②与⑤之间的关系为同系物,②③④⑤四种物质按它们的沸点由高到低的顺序排列正确的是②④⑤③(填序号).
(2)某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题:写出A的电子式
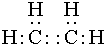 ,E的结构简式为
,E的结构简式为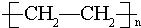 .
.(3)写出反应③的化学方程式,并注明反应类型:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,反应类型加成反应.
(4)除去B中混有的少量杂质A,所用的试剂为溴水.
分析 (1)同分异构体是分子式相同结构不同的物质;同系物是结构相似,组成上相差CH2原子团的物质互称同系物;
(2)、(3)、(4)烃A的产量可以用来衡量一个国家的石油化工发展水平,还是一种植物生长调节剂,故A为乙烯,乙烯与氢气发生加成反应生成B,B为乙烷,乙烯与HCl发生加成反应生成C,C为CH3CH2Cl,乙烯与水发生加成反应生成D,D为乙醇,乙烯发生加聚反应生成高分子化合物E,E是聚乙烯,据此答题.
解答 解:(1)①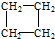 为环烷烃,与同碳原子数的烯烃属于同分异构体;
为环烷烃,与同碳原子数的烯烃属于同分异构体;
② 为戊烷,属于饱和烷烃;
为戊烷,属于饱和烷烃;
③乙烷属于饱和烷烃;
④戊烷为饱和烷烃;
⑤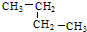 为丁烷,属于饱和烷烃;故②④分子式相同,结构不同,属于同分异构体;②与⑤是结构相似、组成上相差1个CH2原子团,故互为同系物;
为丁烷,属于饱和烷烃;故②④分子式相同,结构不同,属于同分异构体;②与⑤是结构相似、组成上相差1个CH2原子团,故互为同系物;
分子组成相似,相对分子质量越大,熔沸点越高,碳原子数相同时,支链越多,沸点越低,故②③④⑤四种物质按它们的沸点由高到低的顺序排列正确的是:②④⑤③,
故答案为:②④;同系物;②④⑤③;
烃A的产量可以用来衡量一个国家的石油化工发展水平,还是一种植物生长调节剂,故A为乙烯,乙烯与氢气发生加成反应生成B,B为乙烷,乙烯与HCl发生加成反应生成C,C为CH3CH2Cl,乙烯与水发生加成反应生成D,D为乙醇,乙烯发生加聚反应生成高分子化合物E,E是聚乙烯,
(2)A为乙烯,电子式为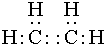 ,E是聚乙烯,结构简式为
,E是聚乙烯,结构简式为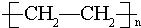 ,
,
故答案为: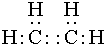 ;
;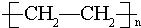 ;
;
(3)反应③是乙烯与水发生加成反应生成CH3CH2OH,反应方程式为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH;加成反应;
(4)B为乙烷,A为乙烯,除去乙烷中混有的少量杂质乙烯,可以用溴水,乙烯与溴水发生加成反应生成1,2-二溴乙烷,而除去乙烯,
故答案为:溴水.
点评 本题考查有机物的结构和性质,为高考常见题型和高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握有机物官能团的性质,为解答该题的关键.考查有机物的推断,比较基础,旨在考查学生对基础知识的掌握,注意基础知识的全面掌握.

 名校课堂系列答案
名校课堂系列答案| A. | 容器内压强不随时间变化而变化 | |
| B. | 单位时间消耗0.1mol X同时生成0.3mol Z | |
| C. | 容器内X、Y、Z的浓度之比为1:2:3 | |
| D. | 容器内各物质的浓度不随时间变化而变化 |
①Na2SiO3②CaCO3③CaSiO3④SiO2⑤Na2CO3.
| A. | ①③⑤ | B. | ②③④ | C. | ①③④ | D. | ③④⑤ |
| A. | 正丁烷 | B. | 异丁烷 | C. | 异戊烷 | D. | 新戊烷 |
| A. | 金属越纯越不易被腐蚀 | |
| B. | 干燥环境下金属不被腐蚀 | |
| C. | 铜一定比铁难腐蚀 | |
| D. | 金属的腐蚀有化学腐蚀和电化学腐蚀 |
| A. | 红墨水加到清水使整杯水变红 | B. | 冰在室温下融化成水 | ||
| C. | 铁器在潮湿的空气中生锈 | D. | NaHCO3转化为Na2CO3 |
-CH3+2KMnO4$\stackrel{△}{→}$-COOK+KOH+2MnO2↓+H2O
-COOK+HCl→-COOH+KCl
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
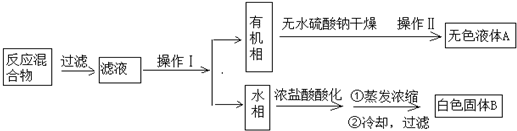
已知:苯甲酸相对分子质量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是溶液颜色褪去.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确,请完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中, 加热溶解,冷却结晶、过滤 | 得到白色晶体和无色溶液 | 无 |
| ② | 取少量滤液于试管中, 滴入稀HNO3和AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,测定熔点 | 白色晶体在122.4℃左右完全熔化 | 白色晶体是苯甲酸 |