题目内容
17.根据下表信息,判断以下叙述正确的是( )部分短周期元素的原子半径及主要化合价,
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.075 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R,金属性L>Q | |
| B. | M与T形成的化合物具有两性 | |
| C. | L2+与R2-的核外电子数相等 | |
| D. | L的原子半径最大,电负性最小,T的原子半径最小,电负性最大 |
分析 短周期元素,T、R都有-2价,处于ⅥA族,T只有-2价,则T为O元素、R为S元素,L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg元素、Q为Be元素,M有+3价,处于ⅢA族,原子半径M的介于L、R之间,则M为Al元素.
解答 解:短周期元素,T、R都有-2价,处于ⅥA族,T只有-2价,则T为O元素、R为S元素,L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg元素、Q为Be元素,M有+3价,处于ⅢA族,原子半径M的介于L、R之间,则M为Al元素.
A.同主族自上而下金属性增强,金属性Mg>Be,水分子之间存在氢键,沸点H2O>H2S,故A错误;
B.M与T形成的化合物是氧化铝,属于两性氧化物,故B正确;
C.L2+的核外电子数为12-2=10,R2-的核外电子数为16-(-2)=18,不相等,故C错误;
D.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径Mg>O,非金属性越强,电负性越大,故电负性Mg<O,故D正确,
故选BD.
点评 本题考查结构性质位置关系应用,利用原子半径及化合价来推断出元素是解答本题的关键,注意对元素周期律的理解掌握,难度不大.

练习册系列答案
相关题目
18.鉴别溶液和胶体的最简便方法是( )
| A. | 电解 | B. | 电泳 | C. | 丁达尔现象 | D. | 用显微镜观察 |
8.氯元素的天然同位素有35Cl 和37Cl.氯元素的相对原子质量为35.45,则天然氯元素中35Cl 和37Cl的原子数目之比约为( )
| A. | 3:1 | B. | 1:3 | C. | 3:2 | D. | 4:1 |
12.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 室温下,22.0g C18O2气体中含有的碳原子数目为0.5NA | |
| B. | 1mol OH-中电子数为10NA | |
| C. | 标准状况下,22.4L乙醇中含有的氧原子数为1.0NA | |
| D. | 1mol C2Cl6分子含有7 NA个共价键 |
2.下列判断正确的是( )
| A. | 可用催化氢化法除去甲烷中的少量乙烯 | |
| B. | 苯与液溴反应,苯与H2反应属于同一类型的反应 | |
| C. | 苯不能使KMnO4溶液褪色,所以苯不能发生氧化反应 | |
| D. | 丙炔可以发生取代反应,加成反应、加聚反应 |
9.在一定条件下的密闭容器中,一定能说明反应A(g)+3B(g)?2C(g)+2D(g)达到平衡状态的是( )
| A. | 反应体系的总压恒定 | B. | A、B、C、D的物质的量之比为1:3:2:2 | ||
| C. | c(A):c(B)=1:3 | D. | 2V(B)正=3V(C)逆 |
6.X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
请回答下列问题:
(1)W位于周期表中第三周期,第ⅦA族.
(2)X和氢可以构成+1价阳离子,其电子式是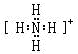 ,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
(3)X的最高价氧化物的水化物与其氢化物能化合生成M,M的水溶液显酸性的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)①Y和Z可组成一种气态化合物Q,Q能与W的单质在潮湿环境中反应,反应的化学方程式是SO2+Cl2+2H2O=2HCl+H2SO4.
②在一定条件下,化合物Q与Y的单质反应达平衡时有三种气态物质,反应时,每转移4mol电子放热190.0kJ,该反应的热化学方程式是2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.
| X | Y | |
| Z | W |
(1)W位于周期表中第三周期,第ⅦA族.
(2)X和氢可以构成+1价阳离子,其电子式是
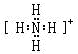 ,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).(3)X的最高价氧化物的水化物与其氢化物能化合生成M,M的水溶液显酸性的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)①Y和Z可组成一种气态化合物Q,Q能与W的单质在潮湿环境中反应,反应的化学方程式是SO2+Cl2+2H2O=2HCl+H2SO4.
②在一定条件下,化合物Q与Y的单质反应达平衡时有三种气态物质,反应时,每转移4mol电子放热190.0kJ,该反应的热化学方程式是2SO2 (g)+O2(g)?2SO3(g)△H=-190.0 kJ•mol-1.
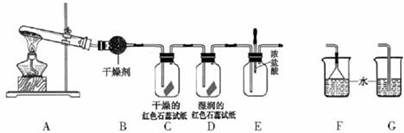
 铁(26Fe)是地球上分布最广的金属之一,约占地壳质量的5.1%,居元素分布序列中的第四位,仅次于O、Si和Al.请结合所学知识回答下列问题:
铁(26Fe)是地球上分布最广的金属之一,约占地壳质量的5.1%,居元素分布序列中的第四位,仅次于O、Si和Al.请结合所学知识回答下列问题: