题目内容
8.实验室配制480mL0.08mol/LNa2CO3溶液回答下列问题(1)应用托盘天平称取十水合碳酸钠晶体11.4g
(2)若在称量样品时,药品放在天平右盘上,砝码放在天平左盘上,天平平衡时,则实际称量的碳酸钠晶体是10.6g(1g以下用游码)
(3)用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是B
A、干燥的 B、瓶塞不漏水 C、用欲配制的溶液润洗过 D、以上三项都要求
(4)若实验遇下列情况,溶液的浓度是偏高,偏低还是不变?
A.加水时越过刻度线偏低
B.忘记将洗涤液加入容量瓶偏低
C.容量瓶内壁附有水珠而未干燥处理无影响
D.溶解后没有冷却便进行定容偏高.
分析 (1)根据n=cv计算溶质Na2CO3的物质的量,利用Na2CO3•10H2O的物质的量等于Na2CO3的物质的量,根据m=nM计算Na2CO3•10H2O的质量;
(2)根据天平的称量原理;
(3)根据容量瓶的使用方法分析;
(4)根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断.
解答 解:(1)因配制溶液的体积为480ml,而容量瓶的规格没有480ml,只能选用500ml,Na2CO3的物质的量n=cV=0.5L×0.08mol•L-1=0.04mol,Na2CO3•10H2O的物质的量等于Na2CO3的物质的量,所以Na2CO3•10H2O的质量0.04mol×286g/mol=11.4g,
故答案为:11.4;
(2)因天平的称量原理:左盘物体的质量=右盘物体的质量+游码的读数,11.4g=m+0.4×2g,则实际称量的碳酸钠晶体m=10.6g,
故答案为:10.6;
(3)容量瓶使用前,必须检验是否漏水,故答案为:B;
(4)A、仰视刻度线,溶液的体积偏大,浓度偏低;
B、忘记将洗涤液转入容量瓶,溶质的质量偏小,浓度偏低;
C、容量瓶内壁附有水珠而未干燥处理,溶液的体积不变,浓度不变;
D、溶解后没有冷却便进行定容,溶液的体积偏小,浓度偏高,
故答案为:偏低、偏低、无影响、偏高.
点评 本题考查了一定物质的量浓度溶液的配制过程以及误差分析,难度不大,注意实验的基本操作方法和注意事项.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列电子排布式中,原子处于激发态的是( )
| A. | 1s22s22p1 | B. | 1s22s22p33s1 | ||
| C. | 1s22s22p63s23p63d104s2 | D. | 1s22s22p63s23p63d34s2 |
19.醇广泛存在于自然界中,是一类重要的有机化合物,请判断下列物质中不属于醇类的是( )
| A. | 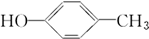 | B. | 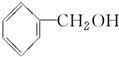 | C. | CH3OH | D. | 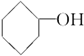 |
16.下表列出了A~R十二种元素在周期表中的位置:
请用相应的化学符号和化学用语回答下列问题:
(1)其中化学性质最不活泼的是Ar,最活泼的金属元素是K;
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH;其中J与F按原子个数1:1所成的化合物的电子式为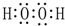 .
.
(3)A、B、C三种元素按离子半径由大到小的顺序排列为K+>Na+>Mg2+;
(4)E和J形成原子个数比为1:3化合物的结构简式CH3CH3,该物质与G的单质在一定条件下发生取代反应生成的二取代产物有2种.
(5)元素G的气态氢化物比元素H的气态氢化物稳定(填“稳定”或“不稳定”).元素K和I的气态氢化物沸点较高的是NH3(填化学式).其原因是氨气分子之间存在氢键.
(6)元素G的单质溶于元素A的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的化学式为NaClO,该化合物中所含的化学键类型为_离子键、共价键.
(7)元素B、C、D的简单阳离子的氧化性比较Al3+>Mg2+>Na+.(填离子符号)
(8)1g元素J的单质完全燃烧生成液态氧化物时放出的热量为142.9KJ,写出元素J的单质燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1 .
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | K | F | |||||
| 3 | A | C | D | I | G | R | ||
| 4 | B | H |
(1)其中化学性质最不活泼的是Ar,最活泼的金属元素是K;
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH;其中J与F按原子个数1:1所成的化合物的电子式为
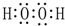 .
.(3)A、B、C三种元素按离子半径由大到小的顺序排列为K+>Na+>Mg2+;
(4)E和J形成原子个数比为1:3化合物的结构简式CH3CH3,该物质与G的单质在一定条件下发生取代反应生成的二取代产物有2种.
(5)元素G的气态氢化物比元素H的气态氢化物稳定(填“稳定”或“不稳定”).元素K和I的气态氢化物沸点较高的是NH3(填化学式).其原因是氨气分子之间存在氢键.
(6)元素G的单质溶于元素A的最高价氧化物对应的水化物中,可生成具有漂白作用的一种盐,该盐的化学式为NaClO,该化合物中所含的化学键类型为_离子键、共价键.
(7)元素B、C、D的简单阳离子的氧化性比较Al3+>Mg2+>Na+.(填离子符号)
(8)1g元素J的单质完全燃烧生成液态氧化物时放出的热量为142.9KJ,写出元素J的单质燃烧热的热化学方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1 .
3.下列离子方程式书写正确的是( )
| A. | 向Fe2(SO4)3溶液中加入过量的Na2S:2Fe3++S2-=2Fe2++S↓ | |
| B. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| C. | 用铜作电极电解饱和食盐水:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 将铜屑加入Fe3+ 溶液中:2Fe3++Cu=2Fe2++Cu2+ |
13.有人认为在元素周期表中,位于ⅠA族的氢元素,也可放ⅦA族,下列能支持这一观点的是( )
| A. | HF | B. | NaH | C. | H3O+ | D. | NH4Cl |
 .⑦的电子式为
.⑦的电子式为 .
.