题目内容
氮是地球上含量丰富的—种元素,氮及其化合物在工农业生产、生活中有着重要作用,
减少N 的氧化物在大气中的排放是环境保护的重要内容之一。

(1)上图是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式________________________________________;
又知:N2(g)+ O2(g)=2NO(g) △H=+180kJ/mol;2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol,则反应2NO(g)+2CO(g) N2(g)+ 2CO2(g)的△H=_______________;
N2(g)+ 2CO2(g)的△H=_______________;
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g) + O2(g) 2N2O5(g)。已知体系中n(NO2)随时间变化加下表:
2N2O5(g)。已知体系中n(NO2)随时间变化加下表:
①写出该反应的平衡常数表达式:K=__________,己知:K300℃>K350℃,则该反应是______热反应。
②反应达到平衡后,NO2的转化率为________________,此时若再通入一定量氮气,则NO2的转化率将___________(填“增大”、“减小”、“不变”);
③图中表示N2O5的浓度的变化曲线是____,用O2表示从0~500 s内该反应的平均速率v=________。

减少N 的氧化物在大气中的排放是环境保护的重要内容之一。

(1)上图是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式________________________________________;
又知:N2(g)+ O2(g)=2NO(g) △H=+180kJ/mol;2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol,则反应2NO(g)+2CO(g)
 N2(g)+ 2CO2(g)的△H=_______________;
N2(g)+ 2CO2(g)的△H=_______________;(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g) + O2(g)
 2N2O5(g)。已知体系中n(NO2)随时间变化加下表:
2N2O5(g)。已知体系中n(NO2)随时间变化加下表:| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
①写出该反应的平衡常数表达式:K=__________,己知:K300℃>K350℃,则该反应是______热反应。
②反应达到平衡后,NO2的转化率为________________,此时若再通入一定量氮气,则NO2的转化率将___________(填“增大”、“减小”、“不变”);
③图中表示N2O5的浓度的变化曲线是____,用O2表示从0~500 s内该反应的平均速率v=________。

(1)NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ/mol(2分);-760.3 kJ/mol(2分)
(2)①K= (2分);放(1分) ②49.6%(2分);不变(1分)
(2分);放(1分) ②49.6%(2分);不变(1分)
③c(2分);1.51×10-3mol/(L·s)-1(2分)
(2)①K=
 (2分);放(1分) ②49.6%(2分);不变(1分)
(2分);放(1分) ②49.6%(2分);不变(1分)③c(2分);1.51×10-3mol/(L·s)-1(2分)
试题分析: (1)根据图像可知,1molNO2和1mol CO所具有的总能量高于1molCO2和1molNO所具有的总能量,因此该反应是放热反应,反应热△H=134 kJ/mol-368kJ/mol=-234kJ/mol,所以该反应的热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ/mol。已知①N2(g)+ O2(g)=2NO(g) △H=+180kJ/mol;②2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol;③NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ/mol,则根据盖斯定律可知,②-①+③×2即得到反应2NO(g)+2CO(g)
 N2(g)+ 2CO2(g),所以该反应的反应热△H=-112.3kJ/mol-180kJ/mol-234kJ/mol×2=-760.3 kJ/mol。
N2(g)+ 2CO2(g),所以该反应的反应热△H=-112.3kJ/mol-180kJ/mol-234kJ/mol×2=-760.3 kJ/mol。(2)①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,该反应的平衡常数K=
 。己知:K300℃>K350℃,这说明升高温度平衡向逆反应方向移动,平衡常数减小,所以该反应是放热反应。
。己知:K300℃>K350℃,这说明升高温度平衡向逆反应方向移动,平衡常数减小,所以该反应是放热反应。②根据表中数据可知,反应进行到1000s时,NO2的物质的量不再发生变化。此时NO2的物质的量是10.08mol,则反应中消耗NO2的物质的量是20mol-10.08mol=9.92mol,反应达到平衡后,NO2的转化率为
 ×100%=49.6%。平衡时若再通入一定量氮气,压强增大,但由于物质的浓度不变,因此平衡不移动,则NO2的转化率不变。
×100%=49.6%。平衡时若再通入一定量氮气,压强增大,但由于物质的浓度不变,因此平衡不移动,则NO2的转化率不变。③N2O5是生成物,根据方程式可知,平衡时生成N2O5的物质的量是9.92mol÷2=4.96mol,其浓度是4.96mol÷2L=2.48mol/L,所以符合条件的曲线是c;根据表中数据可知,反应进行到500s时消耗NO2的物质的量是20mol-13.96mol=6.04mol,则根据方程式可知,消耗氧气的物质的量是6.04mol÷4=1.51mol,其浓度是1.51mol÷2L=0.755mol/L,所以用O2表示从0~500 s内该反应的平均速率v=0.755mol/L÷500s=1.51×10-3mol/(L·s)-1。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1②
O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1②

 H2(g)+
H2(g)+ kJ·mol-1
kJ·mol-1
 4NO(g) △H=+292.3kJ·mol—1,
4NO(g) △H=+292.3kJ·mol—1,

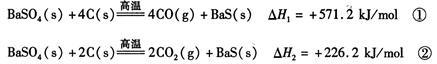
 2CO(g)的△H = kJ/mol
2CO(g)的△H = kJ/mol = 。[已知:
= 。[已知:
 CH3OCH3(g) + CO2(g),ΔH=-247kJ/mol
CH3OCH3(g) + CO2(g),ΔH=-247kJ/mol