��Ŀ����
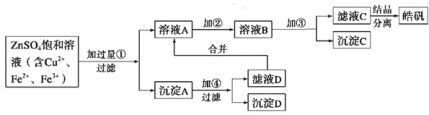
����Ŀ��һ���¶����п��淴Ӧ��A��g��+2B��g��![]() 2C��g��+D��g�����ֽ�5mol A��10mol B����һ���Ϊ2L���ܱ������У���Ӧ��10minʱ�ı�ijһ������C�����ʵ���Ũ����ʱ��仯��ϵ��ͼ��ʾ�������й�˵����ȷ����
2C��g��+D��g�����ֽ�5mol A��10mol B����һ���Ϊ2L���ܱ������У���Ӧ��10minʱ�ı�ijһ������C�����ʵ���Ũ����ʱ��仯��ϵ��ͼ��ʾ�������й�˵����ȷ����
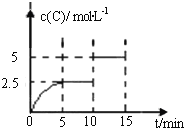
A.��0��5min�ڣ�����Ӧ����������
B.��Ӧ����ʼ��5minʱ��B��ת����Ϊ50%
C.5minʱ��ƽ�ⳣ����10minʱ��ƽ�ⳣ������
D.��15minʱ��B���������Ϊ25%
���𰸡�B
��������
A������ͼ���֪��0��5min��C�����ʵ���Ũ��������˵����Ӧ����������У���Ӧ���Ũ����С����������Ӧ��������С��A����
B��5mol A��10mol B����һ���Ϊ2L���ܱ������У���c��A��=2.5mol/L��c��B��=5mol/L����
A��g��+2B��g��![]() 2C��g��+D��g��
2C��g��+D��g��
��ʼŨ�ȣ�mol/L�� 2.5 5 0
��Ӧ�仯��Ũ�ȣ�mol/L�� 1.25 2.5 2.5
ƽ��ʱ��Ũ�ȣ�mol/L�� 1.25 2.5 2.5
B��ת������=![]() =50%��B��ȷ��
=50%��B��ȷ��
C��ƽ�ⳣ��ֻ���¶��йأ����������������أ��������¶�û�б仯�����Ի�ƽ�ⳣ�����䣬C����
D������ͼ���֪����10min��15minʱ��ƽ��û���ƶ�����15minʱ��B����������͵�10minʱ��һ�����ڵ�10minʱ��
A��g��+2B��g��![]() 2C��g��+D��g��
2C��g��+D��g��
��ʼ���ʵ�����mol�� 5 10 0 0
��Ӧ�仯�����ʵ�����mol�� 2.5 5 5 2.5
ƽ��ʱ�����ʵ�����mol�� 2.5 5 5 2.5
���B���������=![]() =33.3%��D����
=33.3%��D����
��ѡB��

����Ŀ�������ҹ��Ƽ��ɹ����漰���ʵ�Ӧ���У�������������ѧ�仯����
|
|
|
|
A���״���������������������Դ���� | B��뮡������������̫�����˾۱�ȼ�� | C��ƫ�����������������칬�������Ļ��ȼ�� | D�����ɿ�ȼ����������Ϊ��Դʹ�� |
A. A B. B C. C D. D