题目内容
【题目】硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还原处理。其主要反应原理如下:4NO+4NH3+O2![]() 4N2+6H2O;6NO2+8NH3
4N2+6H2O;6NO2+8NH3![]() 7N2+12H2O。
7N2+12H2O。
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4:1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
(1)尾气中氮氧化合物的平均相对分子质量为___。
(2)尾气中NO的含量为___mg/m3。
(3)要处理5m3的尾气,需要氨氧混合气的体积为___L。
另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收。
(4)NaOH溶液的物质的量浓度为___mol/L,体积为___mL。
(5)已知反应后溶液中含有0.35molNaNO2。若将尾气中NO与NO2的平均组成记为NOx,通过计算求x___。
【答案】19.37 1800 10.64 8 62.5 1.8
【解析】
(1)先根据尾气中二氧化氮和一氧化氮的关系计算二氧化氮、一氧化氮的物质的量,再根据方程式计算氨气和氧气的物质的量,最后根据M=![]() 计算其平均相对分子质量;
计算其平均相对分子质量;
(2)根据m=nM计算;
(3)根据V=nVm计算需要氨氧混合气体的体积;
(4)①c=![]() ,根据原子守恒知,氮氧化物的物质的量等于氢氧化钠的物质的量,再根据V=
,根据原子守恒知,氮氧化物的物质的量等于氢氧化钠的物质的量,再根据V=![]() 计算;
计算;
②根据方程式2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O中氮原子守恒计算NO和NO2的物质的量分别是多少,根据氧原子守恒解答。
(1)设1m3尾气中NO2的物质的量为x,则NO的物质的量为4x,4xmol×30g/mol+46xg=2.49g,x=0.015mol,所以1m3尾气中NO2的物质的量为0.015mol,则NO的物质的量为0.06mol,根据4NO+4NH3+O2![]() 4N2+6H2O知,0.06molNO需要0.06molNH3,0.015molO2,根据方程式6NO2+8NH3
4N2+6H2O知,0.06molNO需要0.06molNH3,0.015molO2,根据方程式6NO2+8NH3![]() 7N2+12H2O,0.015molNO2需要0.02molNH3,所以氮氧化物混合气体的平均摩尔质量为
7N2+12H2O,0.015molNO2需要0.02molNH3,所以氮氧化物混合气体的平均摩尔质量为![]() =33.2g/mol,所以其相对分子质量为33.2;
=33.2g/mol,所以其相对分子质量为33.2;
(2)1m3尾气中NO的物质的量为0.06mol,所以其m=nM=0.06mol×30g/mol=1.8g=1800mg;
(3)处理1m3尾气需要氨氧混合物的体积=(0.06+0.02+0.015)mol×22.4L/mol=2.128L,则要处理5m3的尾气,需要氨氧混合气的体积为=2.128L×5=10.64L;
(4)①c=![]() ,根据原子守恒知,氮氧化物的物质的量等于氢氧化钠的物质的量,所以V=
,根据原子守恒知,氮氧化物的物质的量等于氢氧化钠的物质的量,所以V=![]() =62.5mL;
=62.5mL;
②2NO2+2NaOH=NaNO2+NaNO3+H2O和NO+NO2+2NaOH=2NaNO2+H2O,根据氮原子守恒知,生成0.35mol亚硝酸钠则生成0.15mol硝酸钠,生成0.15mol硝酸钠需要0.3mol二氧化氮,同时生成0.15mol亚硝酸钠,0.2mol亚硝酸钠需要0.1mol一氧化氮,所以二氧化氮的物质的量是0.4mol,根据氧原子守恒得x=![]() =1.8。
=1.8。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
【题目】用以下图示装置研究物质的性质,能够获得可靠结论的是
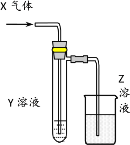
X | Y | Z | 结论 | |
A | HCHO | 新制Cu(OH)2 | NaOH(aq) | 验证甲醛的还原性 |
B | CH3Cl | AgNO3(aq) | NaOH(aq) | 验证一氯甲烷含氯元素 |
C | SO2 | KMnO4(aq) | NaOH(aq) | 验证二氧化硫的漂白性 |
D | Cl2 | 淀粉KI(aq) | NaOH(aq) | 验证氯气的强氧化性 |
A.AB.BC.CD.D