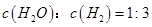题目内容
在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系: Cr2O72- + H2O 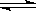 2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液,溶液呈____色,因为 。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4,则溶液呈 色, 因为 。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡 ,溶液颜色将 。
(每空2分,共12分) ⑴黄; 中和H+平衡向正反应方向移动
⑵橙红色; 增加生成物浓度平衡向逆反应方向移动 ⑶正反应方向移动; 变浅
解析试题分析:(1)加入少量NaOH固体后,中和溶液中的氢离子,导致氢离子浓度降低,平衡向右移动,所以溶液呈黄色。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4,则增加生成物浓度平衡向逆反应方向移动,Cr2O72-浓度增大,溶液呈橙红色。
(3)向原溶液中加入Ba(NO3)2溶液,生成BaCrO4沉淀,CrO42-浓度降低,平衡正向移动,溶液的颜色变浅。
考点:考查外界条件对平衡状态的影响
点评:该题是基础性试题的考查,难度不大。试题紧扣教材,针对性强,主要是考查学生灵活运用勒夏特例原理解决实际问题的能力,有利于培养学生的逻辑思维能力和发散思维能力。

工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度℃ | ||
| 500 | 700 | 800 | ||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
③3H2(g)+CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) | K3 | | | |
请回答下列问题:
(1)反应②是 (填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol·L-1)分别为0.8、0.1、0.3、0.15,则此时V正 V逆(填“ > ”、“=”或“<”)。
(4)反应①按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是_____________(填序号)。

A.温度:T1>T2>T3
B.正反应速率:υ(a)>υ(c) , υ(b)>υ(d)
C.平衡常数:K(a)>K(c) , K(b)=K(d)
D.平均摩尔质量:M(a)>M(c) , M(b)>M(d)
将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入0.5 L密闭容器内,550℃时,在催化剂作用下发生反应:2SO2(g)+O2(g) 2SO3(g)(正反应放热)。测得n(O2)随时间的变化如下表
2SO3(g)(正反应放热)。测得n(O2)随时间的变化如下表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(O2)/mol | 0.7 | 0.4 | 0.3 | x | x | x |
反应达到5s后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了22.4L(此体积为标准状况下的体积);再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(此体积为标准状况下的体积)。
请回答下列问题:
(1)用O2表示从0~1s内该反应的平均反应速率为 ;
(2)O2的平衡浓度c(O2)= ;
(3)4s时,SO2的生成速率____________(填“大于”、“小于”或“等于”)O2的消耗速率。
(4)求该反应达到平衡时SO2的转化率是____________(用百分数表示)。
(5)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀____________克(计算结果保留一位小数)。
[15分]甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 反应过程 | 化学方程式 | 焓变△H (kJ/mol) | 活化能Ea (kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g) CO2(g)+2H2O(g) CO2(g)+2H2O(g) | -802.6 | 125.6 |
CH4(g)+O2(g) CO2(g)+2H2(g) CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g) CO(g)+3H2(g) CO(g)+3H2(g) | 206.2 | 240.1 |
CH4(g)+2H2O(g) CO2(g)+4H2(g) CO2(g)+4H2(g) | 165.0 | 243.9 |
(1)反应CO(g)+H2O(g)
 CO2(g)+H2(g)的△H= kJ/mol。
CO2(g)+H2(g)的△H= kJ/mol。(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以平衡常数(记作KP),则反应CH4(g)+H2O(g)
 CO(g)+3H2(g)的KP= ;
CO(g)+3H2(g)的KP= ;随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量阶段分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
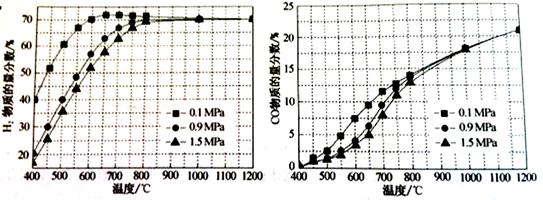
①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是 。
A.600℃,0.9Mpa B.700℃,0.9MPa C.800℃,1.5Mpa D.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始即时)
的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
 N2O3(g) ΔH<0
N2O3(g) ΔH<0 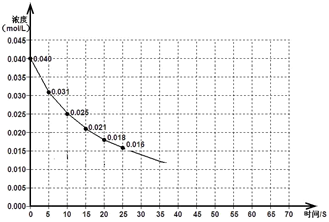
 C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。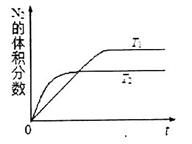
 的醋酸与b mol
的醋酸与b mol L
L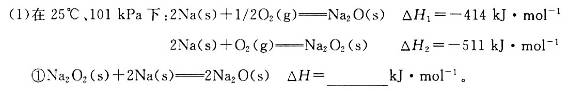
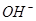 向_________极移动。
向_________极移动。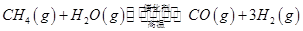 。一定温度下,向2 L容积不变的密闭容器中充入4 mol
。一定温度下,向2 L容积不变的密闭容器中充入4 mol 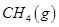 和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。
和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。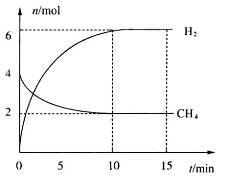
 (CO)表示的化学反应速率为_________。
(CO)表示的化学反应速率为_________。