题目内容
(18分)碱金属元素的单质及其化合物被广泛应用于生产、生活中。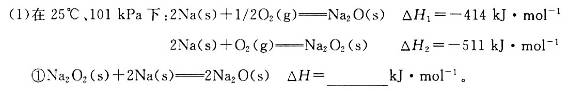
②一定量的Na在足量O2中充分燃烧,参加反应的O2体积为5.6 L(标准状况),则该反应过程中转移电子的数目为_________。
(2)金属锂广泛应用于化学电源制造,锂水电池就是其中的一种产品。该电池以金属锂和 钢板为电极材料,以LiOH为电解质,加入水即可放电。
总反应为:2Li+2H2O=2LiOH+H2↑
①锂水电池放电时,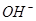 向_________极移动。
向_________极移动。
②写出该电池放电时正极的电极反应式:_________________。
③电解熔融LiCl可以制备金属Li。但LiC1熔点在873 K以上,高温下电解,金属Li产量极低。经过科学家不断研究,发现电解LiCl—KCl的熔盐混合物可以在较低温度下生成金属Li。
你认为,熔盐混合物中KCl的作用是_________________________________________。
写出电解该熔盐混合物过程中阳极的电极反应式:______________________________。
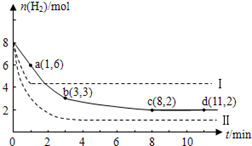
(3)最新研究表明,金属钾可作工业上天然气高温重整的催化剂,有关反应为: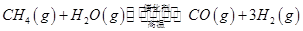 。一定温度下,向2 L容积不变的密闭容器中充入4 mol
。一定温度下,向2 L容积不变的密闭容器中充入4 mol 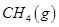 和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。
和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。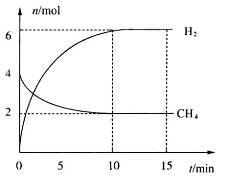
①0~10 min内用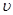 (CO)表示的化学反应速率为_________。
(CO)表示的化学反应速率为_________。
②下列叙述中,能够证明该反应已达到平衡状态的是_________(填序号)。
a.生成3 molH-H键的同时有4 molC-H键断裂
b.其他条件不变时,反应体系的压强保持不变
c.反应混合气体的质量保持不变
d.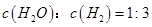
③此温度下,该反应的化学平衡常数K=_________mo12·L-2。
(18分)
(1)①—317(2分)②3.01×1025或0.5NA(2分)
(2)①负(2分)②2H2O+2e?=2OH?+H2↑(2分)③降低LiCl的熔点(2分);2Cl?-2e?=Cl2↑(2分)
(3)①0.1mol?L-1?min-1(2分)②b(2分)③13.5(2分)
解析试题分析:(1)①根据盖斯定律,?H=2?H1—?H2=—317kJ?mol?1
②Na在足量O2中充分燃烧,生成Na2O2,参加反应的O2体积为5.6 L(标准状况),物质的量为0.25mol,则该反应过程中转移电子的物质的量为0.5mol,则数目为3.01×1025或0.5NA。
(2)①原电池内部电解质溶液中阳离子向正极移动,阴离子向阴极移动,所以OH?向阴极移动。
②以LiOH为电解质,加入水即可放电,所以电池放电时正极反应为:2H2O+2e?=2OH?+H2↑
③电解时LiCl为熔融态,电解LiCl—KCl的熔盐混合物可以在较低温度下生成金属Li,所以熔盐混合物中KCl的作用是降低LiCl的熔点;阳极Cl?失电子生成Cl2,电极方程式为:2Cl?-2e?=Cl2↑
(3)①v(CO)=v(CH4)=(4mol-2mol)÷2L÷10min=0.1mol?L-1?min-1。
②a、生成3 molH-H键,说明生成了3mol H2,同时有4 molC-H键断裂,说明1mol CH4反应,都是正反应,错误;b、反应容器恒容,反应前后气体系数不相等,其他条件不变时,反应体系的压强保持不变,证明该反应已达到平衡状态,正确;c、反应物均为气体,根据质量守恒定律,不论反应是否平衡,气体的质量不变,错误;d、H2O与H2的浓度之比与反应是否平衡无关,错误。
③根据图像可得平衡时,c(CO)=1mol?L?1,c(H2)=3mol?L?1,c(CH4)=1mol?L?1,c(H2O)=2mol?L?1,则平衡常数K=33×1÷(1×2)mo12·L-2=13.5mo12·L-2。
考点:本题考查盖斯定律、氧化还原反应原理、原电池与电解池原理、反应速率、化学平衡的判断及计算。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案(13分)近些年来,世界各地频现种种极端天气。二氧化碳、氮氧化物、二氧化硫等是导致极端天气的重要因素,研究这些化合物的综合处理具有重要意义。
(1)工业上可利用二氧化碳和氨气合成尿素,其总反应如下:
2NH3(g)+CO2(g)  CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l) 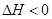 ,该反应在 (填“较高温度”或“较低温度”)下能自发进行。
,该反应在 (填“较高温度”或“较低温度”)下能自发进行。
(2)已知合成尿素分两步进行:
第1步:2NH3(g)+CO2(g) NH2COONH4(s)
NH2COONH4(s) 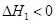
第2步:NH2COONH4(s) CO(NH2)2(l)+ H2O(l)
CO(NH2)2(l)+ H2O(l) 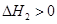
下列示意图中[a表示2NH3(g)+ CO2(g),b表示NH2COONH4(S),c表示CO(NH2)2(l)+ H2O(l)],能正确表示尿素合成过程中能量变化曲线的是(填序号) 。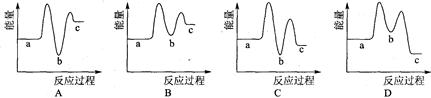
(3)合成尿素过程中,当NH3与CO2的物质的量之比为1:2时,NH3
的转化率随时间的变化关系如图所示。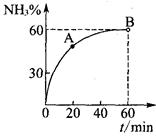
①A点的逆反应速率v逆(CO2) B点的逆反应速率
v逆 (CO2)(填“﹤”“﹥”或“=”)。
②达到平衡时,CO2的转化率为 。
(4)活性炭可用于处理大气污染物NO,在某1L恒容密闭容器中加入 0.100molNO 和2.030mol固体活性炭(无杂质),生成气体E和气体F。当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
 物质 物质n/mol T/℃ | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应在T1℃时的平衡常数为K1,在T2℃时的平衡常数为K2。计算K1= ,根据题给信息判断,T1和T2的关系是 。
A. T1>T2 B. T1<T2 C.无法比较
③若密闭容器为容积可变,根据化学反应原理,分析增加压强对该反应的影响
。
 2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如图所示的规律(图中T表示温度,n表示物质的量):
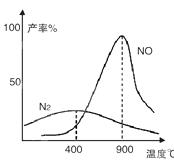
 4NO+6H2O ,4NH3+3O2
4NO+6H2O ,4NH3+3O2 H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
 2CO (g)平衡常数K1;
2CO (g)平衡常数K1; CO(g) +H2 (g)平衡常数K2则K、K1、K2,之间的关系是 :
CO(g) +H2 (g)平衡常数K2则K、K1、K2,之间的关系是 : 2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。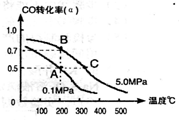
 CH3OH(g)+H2O(g)△H<0,若将6mo1 CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)△H<0,若将6mo1 CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。


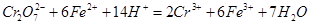 。
。 CH3OH(g)+H2O(g)+49kJ。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.
CH3OH(g)+H2O(g)+49kJ。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.