题目内容
(18分)为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2(g)+O2(g) 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
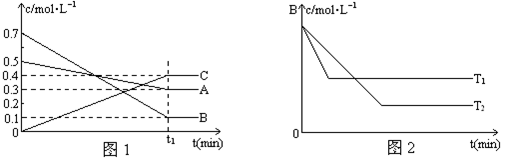
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如图所示,根据图像判断反应N2(g)+O2(g) 2NO(g)的△H__________0(填“>”或“<”)。
2NO(g)的△H__________0(填“>”或“<”)。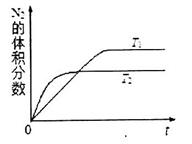
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率v (N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
(2)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。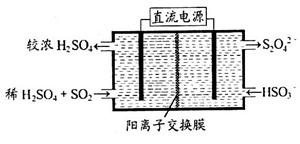
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L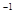 的醋酸与b mol
的醋酸与b mol L
L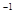 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
(1)① > ②0.01 mol·L-1·s-1 14.3%
(2)①SO2 + 2H2O – 2e-== SO42-+ 4H+ ②1:2
(3) ×10-7 mol·L-1 (不写单位也给分)
×10-7 mol·L-1 (不写单位也给分)
解析试题分析:(1)①根据题给图像判断,一定量的NO发生分解反应时,温度为T2时反应先到达平衡,反应速率大,温度较高,即T2>T1;而温度升高,氮气的体积分数减小,说明升高温度平衡向逆向移动,升高温度平衡向吸热方向移动,故NO的分解反应为放热反应,则N2(g)+O2(g) 2NO(g)为吸热反应,△H>0;②利用三行式计算。
2NO(g)为吸热反应,△H>0;②利用三行式计算。
N2(g)+O2(g) 2NO(g),
2NO(g),
起始(mol/L):5 2.5 0
反应(mol/L):0.5 0.5 1
平衡(mol/L):4.5 2 1
所以v (N2)=△c(N2)/△t=0.01 mol·L-1·s-1,平衡常数k=c2(NO)/c(N2)?c(O2)=1/4.5×2=1/9;
设N2转化浓度为x,则
N2(g)+O2(g) 2NO(g),
2NO(g),
起始(mol/L):0.5 0.5 0
反应(mol/L):x x 2x
平衡(mol/L):0.5-x 0.5-x 2x
则4x2/(0.5—x)2=1/9;,解得x=1/14,N2的转化率为1/14×0.5×100%=14.3%
(2)①根据题给装置图判断,该装置为电解池。二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,电极反应式为SO2-2e-+2H2O═SO42-+4H+。②在碱性条件下,用阴极排出的溶液S2O42-吸收NO2,使其转化为无害气体,同时有SO32—生成。该反应的化学方程式为2NO2+4S2O42-+8OH- 8SO32—+N2+4H2O,其中氧化剂为NO2,还原剂为S2O42-,物质的量之比为1:2。(3)常温下,将a mol·L—1的醋酸与b mol·L—1Ba(OH)2溶液等体积混合,发生的反应为
8SO32—+N2+4H2O,其中氧化剂为NO2,还原剂为S2O42-,物质的量之比为1:2。(3)常温下,将a mol·L—1的醋酸与b mol·L—1Ba(OH)2溶液等体积混合,发生的反应为
2CH3COOH+Ba(OH)2 (CH3COO)2Ba+2H2O,反应后溶液中存在2c(Ba2+)=c(CH3COO-)="b" mol·L—1,根据电荷守恒知,c(H+)=c(OH-)=1×10—7 mol·L—1,溶液呈中性,则反应后醋酸有剩余,混合溶液中剩余醋酸的浓度为(a—2b)/2 mol·L—1,电离常数Ka=c(CH3COO-)c(H+)/c(CH3COOH)=
(CH3COO)2Ba+2H2O,反应后溶液中存在2c(Ba2+)=c(CH3COO-)="b" mol·L—1,根据电荷守恒知,c(H+)=c(OH-)=1×10—7 mol·L—1,溶液呈中性,则反应后醋酸有剩余,混合溶液中剩余醋酸的浓度为(a—2b)/2 mol·L—1,电离常数Ka=c(CH3COO-)c(H+)/c(CH3COOH)= ×10-7 mol·L-1。
×10-7 mol·L-1。
考点:考查化学平衡图像及平衡计算,电解原理应用、氧化还原方程式的书写,电离常数计算。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案(13分)
Cl2是一种重要的化工原料。
(1)电解饱和NaCl溶液获得Cl2的化学方程式是_______。
(2)为便于储存,要将氯气液化[ Cl2(g) 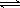 Cl2(l) ],应采取的措施是_______(写出一条即可)。
Cl2(l) ],应采取的措施是_______(写出一条即可)。
(3)液氯储存区贴有的说明卡如下(部分):
| 危险性 | 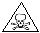 |
| 储运要求 | 远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
② 若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
③ 氯气含量检测仪工作原理示意图如下:
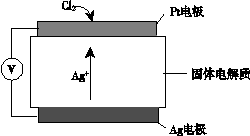
Cl2在Pt电极放电的电极反应式是_______。
(4)质量标准要求液氯含水量(以1 g氯气含水的质量计)<0. 4 mg,含水量超标会严重腐蚀钢瓶。液氯含水量的测定装置如下图所示:

(已知:P2O5 + 3H2O = 2H3PO4;Cl2与P2O5不反应。)
① 用离子方程式说明c装置的作用_______。
② 检测液氯的含水量,根据上图,需要测定的数据是_______。
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g) △H=a kJ·mol-1
3AlCl(g) =2Al(l)+AlCl3(g) △H=b kJ·mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q 0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如下图所示:

请写出该电池正极反应式 ;常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mg Al,则电解后溶液的pH= (不考虑溶液体积的变化)。

 NH3(g) + HI(g)
NH3(g) + HI(g)
 2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。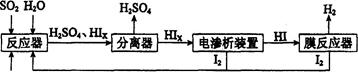
 H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示:
H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示: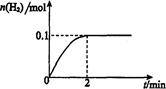

 CH3OH(g)+H2O(g)△H<0,若将6mo1 CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)△H<0,若将6mo1 CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
