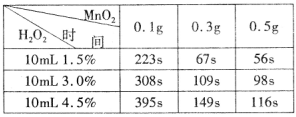
题目内容
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时到达平衡,依图所示:
①该反应的化学方程式是 。
②反应起始至t,Y的平均反应速率是 。
(1)2X 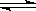 3Y+Z
3Y+Z
(2) 0.6/t mol/(L﹒min)
解析试题分析:(1)由图象可以看出,反应中X的物质的量减小,Y、Z的物质的量增多,则X为反应物,Y、Z为生成物.t时刻后,X的物质的量为定值且不为零,所以该反应为可逆反应,且△n(X):△n(Y):△n(Z)=0.8mol:1.2mol:0.4mol=2:3:1,则反应的化学方程式为:2X 3Y+Z。
3Y+Z。
(2)在tmin时间内,用Y表示反应的平均速率v(Y)=△c(Y) /△t="(1.2mol-0mo" l) /2L/tmin=0.6/t mol/(L﹒min)。
考点:考查物质的量或浓度随时间的变化曲线的分析, 化学反应速率的计算

碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g) △H=a kJ·mol-1
3AlCl(g) =2Al(l)+AlCl3(g) △H=b kJ·mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q 0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如下图所示:

请写出该电池正极反应式 ;常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mg Al,则电解后溶液的pH= (不考虑溶液体积的变化)。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数。
□C+□KMnO4+□H2SO4 =□CO2↑+□MnSO4 +□K2SO4+□
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1条件下,反应从开始至达到平衡,以v(CO2)表示的平均反应速率为 (保留小数点后二位数,下同)。
②实验2条件下平衡常数K=____ _____,该反应为 (填“吸热”或“放热”)反应。
(3)已知在常温常压下:
① 2CH3OH(l) +3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g)=2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g)=H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
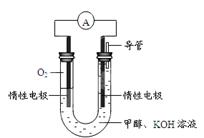
①该电池正极的电极反应式为: ;
②该电池工作时,溶液中的OH-向______(填“正”或“负”)极移动。
 2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。 CH3OH(g)+H2O(g)+49kJ。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.
CH3OH(g)+H2O(g)+49kJ。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.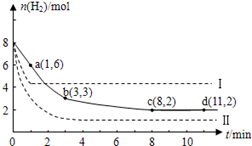
 xC(g)+2D(g),5min后反应达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L.min).求:
xC(g)+2D(g),5min后反应达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L.min).求: 2 NH3
2 NH3