题目内容
【题目】POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
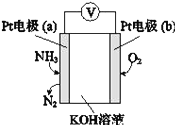
I.实验室制备POCl3。采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:

资料:①Ag++SCN-=AgSCN↓:Ksp(AgCl)>Ksp(Ag SCN);
②PCl3和POCl3的相关信息如下表:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1) 装置B中的作用是观察氧气的流速和______________、_______________ ,干燥管的作用是_____________
(2)反应温度要控制在60~65℃,原因是:________________________________________________
II.测定POCl3产品的含量。
实验步骤:
①制备POCl3实验结束后,待三颈瓶中的液体冷却至室温,准确称取30.7 g产品(杂质不含氯元素),置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL 溶液。
②取10.00 mL溶液于锥形瓶中,加入10.00 mL 3.2 moI/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 moI/L KSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN溶液。
(3)实验室用5.0 moI/L AgNO3 配制100 mL 3.2 moI/L AgNO3标准溶液,所使用的仪器除烧杯和玻璃棒外还有_____________________
(4)步骤③若不加入硝基苯的将导致测量结果_____(填偏高、偏低或无影响)
(5)步骤④中X可以选择_____。
(6)反应中POCl3的质量百分含量为_____,通过_____(填操作)可以提高产品的纯度。
【答案】干燥氧气当压强过大时,长颈漏斗中液面上升,平衡气压 防止空气中的水蒸气进入三颈烧瓶温度过低,反应速度太慢;温度过高,PCl3易挥发,利用率低100 mL容量瓶 胶头滴管偏低Fe (NO3)350%蒸馏
【解析】
(1) 因为POCl3遇水会发生反应,所以装置B中的作用是观察氧气的流速和干燥氧气;B装置中的长颈漏斗和大气相连,所以B还有平衡压强的作用;干燥管可以防止空中的水蒸气进入三颈烧瓶与POCl3发生反应。答案为:干燥氧气、平衡压强;防止空中的水蒸气进入三颈烧瓶。
(2)因为PCl3的沸点为76.0℃,若温度过低,反应速率太慢;温度过高,PCl3易挥发,导致PCl3的利用率低,所以反应温度要控制在60~65℃;答案为:温度过低,反应速率太慢;温度过高,PCl3易挥发,利用率低。
(3)实验室用5.0 mol/L AgNO3 配制100 mL 3.2 mol/L AgNO3标准溶液,所使用的仪器除烧杯和玻璃棒外还需要100 mL容量瓶 胶头滴管。答案:100 mL容量瓶 胶头滴管。
(4)实验过程中加入硝基苯的目的是覆盖氯化银,防止沉淀转化生成AgSCN沉淀而导致数据不准确。如无此操作,部分AgCl沉淀会转化为Ag+,使所测Cl元素含量将会偏低;答案为:偏低。
(5)由于是用KSCN溶液滴定溶液中过量的Ag+,而Fe(SCN)3溶液是血红色溶液,所以可用含有Fe3+的Fe(NO3)3溶液作指示剂,当溶液中Ag+反应完全后,再滴加的KSCN溶液就会与溶液中的Fe3+作用,使溶液变为血红色;根据物质的元素组成及关系式可知POCl3~3HCl~3Ag+,n(Ag+)=0.032mol-0.002mol=0.03mol,n(POCl3)=0.01mol,所以三氯氧磷的含量为![]() 100
100![]() =50
=50![]() ;由于POCl3能溶于PCl3,二者在室温下都是液体,而且二者的沸点不同,因此可以通过蒸馏的方法提高产品的纯度。答案为:Fe(NO3)3、50%、蒸馏。
;由于POCl3能溶于PCl3,二者在室温下都是液体,而且二者的沸点不同,因此可以通过蒸馏的方法提高产品的纯度。答案为:Fe(NO3)3、50%、蒸馏。

 阅读快车系列答案
阅读快车系列答案